فيزيک مولکولي...سؤال همراه با جواب
سؤال
فشار بخار اشباع بالاي محلول آبي شکر کمتر از آب خالص است. فشار بخار اشباع آب را psat و اين اختلاف را با 0.05Psat C نشان ميدهيم. C غلظت مولي محلول ميباشد.
يک ظرف استوانهاي که تا ارتفاع h1=10cm با محلول شکر با غلظت C1=2*10-3 پُر شده است، زير ظرف گنبدي بزرگي قرار دارد. همين محلول با غلظت C2=10-3 زير ظرف گنبدي شکل تا سطح h2<µ=18*10-3 kg/mol ميباشد.
جواب
غلظت محلول شکر که روي سطح افقي ريخته شده است، عملاً ثابت ميماند. بعد از برقراري حالت تعادل، غلظت محلول درون محفظه برابر خواهد بود با:
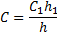
غلظت به دليل تبخير مولکولهاي آب از سطح (غلظت زياد ميشود)، يا به دليل چگالش مولکولهاي بخار به درون محفظه (غلظت کاهش مييابد)، تغيير ميکند. فشار بخار اشباع بالاي محلول درون محفظه استوانهاي به اندازهي:
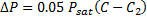
کمتر از بالاي محلولي است که زير آن قرار دارد. اين اختلاف فشار به وسيلهي فشار ستون بخار با ارتفاع h به حالت تعادل ميرسد.
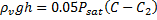
پس به دست خواهيم آورد:
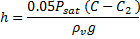
چگالي بخار در دماي 293 کلوين از طريق معادلهي حالت براي يک گاز ايدهآل به دست خواهد آمد:
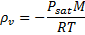
بنابراين ارتفاع h از ستون بخار، معادلهي درجهي دوم زير را به دست ميدهد:
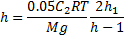
با جايگذاري مقادير عددي و حل معادله:
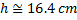
جالب است بدانيد از مسئلهي بالا ميتوان به اين نتيجه رسيد که اگر دو محفظهي يکسان که محلولهايي با غلظت متفاوت هستند، زير يک ظرف گنبدي شکل قرار بگيرند، مايع از محلول با غلظت کمتر بخار خواهد شد. برعکس، بخار آب به درون محلول با غلظت بالاتر چگالش مييابد. در نتيجه غلظتها مايل به برابر شدن هستند. اين موضوع، پديده خيس شدن نمک و شکر در هواي با رطوبت بالا را توضيح ميدهد.