مسابقه 261
در این مسابقه قصد داریم که با مفهوم انرژی یونیزاسیون و مقایسهی انرژی یونیزاسیون عناصر با هم بیشتر آشنا شویم. در مطلب زیر سعی شدهاست علاوه بر تعریف انرژی یونیزاسیون، روشهای مقایسه انرژی یونیزاسیون نیز به طور مختصر گنجانده شود. در پایان نیز میتوانید اطلاعات خود را به همراه اطلاعاتی که در این مسابقه میخوانید با سؤال پایان مطلب محک بزنید.
نخستین انرژی یونیزاسیون در یک اتم یا یک مولکول، انرژی مورد نیاز برای کندن یک الکترون از یک اتم یا مولکول گازیشکل خنثی میباشد.
واحد انرژی یونیزاسیون بسته به علمی که در آن بررسی میشود متفاوت است. در علم فیزیک انرژی یونیزاسیون دارای واحد الکترونولت ( eV) و به انرژی مورد نیاز برای کندن یک الکترون از یک اتم یا مولکول اشاره میکند. در شیمی واحد آن کیلوژول بر مول یا کیلوکالری بر مول میباشد.
nامین انرژی یونیزاسیون (یونش) مقدار انرژی است که باید برای کندن یک الکترون از اتمی که n-1 الکترون از آن کنده شدهاست میگویند. سه انرژی یونش اول اتم X در مقابل نشان داده شدهاست.
به طور عمومی انرژی یونش برای کندن (n+1)امین الکترون بیشتر از انرژی یونش (n)امین الکترون میباشد، زیرا هر بار که میخواهیم الکترون جدیدی را بکنیم باید آن را از اوربیتال نزدیکتری به هستهی اتم کند که در نتیجه باعث میشود انرژی بیشتری برای این کار احتیاج باشد. پس میتوان نتیجه گرفت که هر چقدر الکترونها از هسته دورتر باشند به انرژی یونیزاسین کمتری احتیاج دارند. پس میتواند برای مقایسهی نخستین انرژی یونش عناصر از مفهوم شعاع اتمی برای نتیجهگیری استفاده کرد. یعنی هر چقدر شعاع اتمی (فاصلهی الکترون از هسته) بیشتر باشد نخستین انرژی یونش کاهش مییابد. پس بنابر شکل زیر نخستین انرژی یونش، بنابر جدول تناوبی از پایین به بالا و از چپ به راست افزایش مییابد. پس نخستین انرژی یونش منیزیم از سدیم بیشتر است.
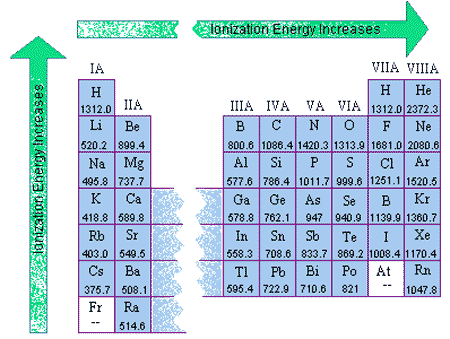 |
اما شعاع اتمی نباید تنها پارامتری باشد که برای مقایسهی نخستین انرژی یونش چک شود. علاوه بر آن، آنچه که نسبت به شعاع اتمی تاثیر بیشتری دارد آرایش الکترونی متقارن است. برای مثال: گازهای نجیب همگی دارای آرایش الکترونی متقارنی هستند و این باعث داشتن نخستین انرژی یونش بسیار زیاد آنها در مقایسه با عناصر دیگر میشود.
تقارن به این معنا است که اوربیتال پایانی آن (s,p,d,f) به طور متقارن پر شده باشد. برای مثال: اگر اوربیتال پایانی پر شده یک عنصر به 3P1 برسد با اینکه دارای شعاع اتمی بیشتری نسبت به عنصری است که به اوربیتال 2s2 ختم شده ولی انرژی یونش آن به دلیل آنکه تقارن ندارد، کمتر است. [به گفتهی قبل دقت شود] برای مقایسهی دومین و بالاتر انرژی یونش میبایست آرایش الکترونی یون اولیه که هنوز دومین الکترون آن کنده نشده است (برای انرژی دومین یونش) را نوشته و با بررسی اوربیتالی که الکترون بعدی که باید کنده شود در آن قرار دارد این مقایسه را انجام دهیم. برای مثال: Na+ به اوربیتال 2P6 ختم شده که برای آنکه الکترون دوم را بخواهیم بکنیم باید یک جهش انجام دهیم و به اوربیتال 3S1 که در Na خنثی بود به اوربیتال 2P6 برویم که در لایهی دوم است، پس انرژی یونش دوم بسیار بیشتر است نسبت به Mg+ که میخواهیم از اوربیتال 3S1 آن که در همان لایه است الکترون بکنیم.
حالا با اطلاعات بالا قطعا میتوانید به سؤال زیر پاسخ دهید و البته با مراجعه به کتاب شیمی دوم دبیرستان نیز میتوانستید به سؤال زیر پاسخ دهید:
کدام یک از گزینههای زیر در مورد مقایسهی اولین انرژی یونش عناصر نادرست است؟
1. F>Na
2. N<O
3. Be>B
4. Li<Be