زنگ تفریح 207، باتریها، پیلها، شیمی و ریاضی، هدایت الکترونها درون سیم توسط شیمی
باتریها، پیلها، شیمی و ریاضی
باتریها منابع انرژی اضطراری خوبی هستند ولی لازم به دانستن یک سری اطلاعات ابتدایی برای استفاده مناسب از آنها هست. باتریها وسایل الکتروشیمیایی هستند. این وسایل دارای صفحات، عموما از جنس فلز و همچنین یک محلول یا ترکیب مرطوب میان صفحات هستند. یک واکنش شیمیایی زمانیکه باتری در حال تخلیه شدن (DisCharge) هست در باتری روی میدهد که تولید یک جریان از الکترونها از قسمت منفی یک صفحه به قسمت مثبت صفحهی دیگر میکند.
در حقیقت یک واحد تک از یک باتری پیل یا سلول نامیده میشود. یک باتری به این دلیل باتری خوانده میشود زیرا یک سری (Battery) از پیلها در کنار هم هست. هر پیل یک دامنهی ولتاژ منحصر بفرد میان حالت شارژ و تخلیه یا همان دشارژ دارد که توسط طبیعت الکتروشیمیایی فلزهای بکار رفته و واکنشهایی که درون محلول، ژل، پودر مرطوب و غیره میان صفحات روی میدهد تعیین میشود.
بعضی از باتریهای غیرقابل شارژ شامل مواد شیمیایی دیگری هستند برای جذب محصولات فرعی واکنشهای شیمایی که الکترونها را حرکت میدهند. این روند برای یک باتری قلیایی (alkaline) هست که باعث میشود طول عمر این باتریها بیشتر شود و قیمت بیشتری نسبت به پیلهای استاندارد کربن/روی داشته باشد. این نوع باتری مقدار اضافی مواد شیمایی برای جذب محصولات فرعی قبل از مسموم شدن باتری دارد. یکی از این نوع مواد شیمایی منگنز دیاکسید است که قسمت بیشتر پودر مرطوب مشکی درون یک باتری پیلی خشک معمولی را شامل میشود.
بعضی پیلها، باتریهایی هستند که میتوانند دوباره شارژ شوند. در این حالت یک منبع انرژی به سیستم اصلی متصل شده که واکنش شیمیایی را به عقب برمیگرداند و آرایش شیمیایی باتری را به همان حالت اولیه برمیگرداند. همهی باتریها نمیتوانند دوباره شارژ شوند وسعی در شارژ دوبارهی باتریهای غیر قابل شارژ میتواند امری کاملا خطرناک باشد، زیرا فشار در محفظه ایجاد شده و محفظه منفجر میشود.
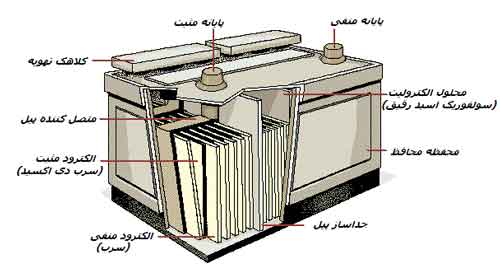
یک نمونه از باتریهای قابل شارژ پیل سرب/اسید میباشد. در این باتری صفحات سرب و سولفوریک اسید استفاده میشوند و سولفات سرب در طی فرایند تخلیه، تولید و مصرف میشود. یک پیل ژلی معمولا یک باتری سرب/اسید است که مادهای در محلول سولفوریک اسید دارد که ناصافی آن را کمتر یا آن را ژلی میکند. چون این باتریها مشکل بیشتری با انتشار گرما و گاز دارند، این پیلهای ژلی آرامتر از باتریهای سرب/اسید معمولی شارژ میشوند.
باتری سرب/اسید به صورت معمول در اتومبیلها از سال 1915 استفاده میشود. این باتریها شامل صفحاتی از سرب در محلول سولفوریک اسید در آب هستند. یک سری از صفحات سربی توسط سرب دیاکسید روکش شدهاند. همزمان با تخلیه این نوع باتری، دو واکنش شیمیایی ایجاد میشود، یکی در آند که با اضافی الکترونها تمام میشود و دیگری در کاتد که با کمبود الکترون تمام میشود. اگر یک سیم میان این دو برقرار شود، الکترونهای اضافی از آند از طریق سیم به صورت یک جریان به سمت کاتد، جایی که الکترونها برای تکمیل واکنش ناقص الکترونی لازم هستند، میروند.
هدایت الکترونها درون سیم توسط شیمی
واکنش آند
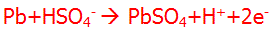
این واکنش بیان میکند که فلز سرب در آند با سولفوریک اسید یونیزه شده واکنش میدهد تا سولفات سرب، یونهای هیدروژن در محلول و 2 الکترون اضافی تولید کند.
واکنش کاتد
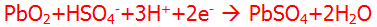
این واکنش بیان میکند که سرب دیاکسید با سولفوریک اسید یونیزه شده و یونهای هیدروژن موجود به همراه چند الکترون اضافی واگذار شده از آند توسط سیم، واکنش میدهد تا سولفات سرب و آب تولید کند.
زمان شارژ شدن، این جریان الکترون به سمت عقب، برخلاف پتانسیل الکتریکی این واکنشها رانده میشود و واکنشها نیز در جهت برگشت یعنی تغییر سولفات سرب به سرب و سرب دیاکسید بر روی صفحات و برگرداندن سولفوریک اسید به محلول، الکترولیت مایع پیشرفت میکنند. چون سولفوریک اسید یک مایف بسیار چگال است، به همراه تغییر مقدار سولفوریک اسید در باتری، چگالی مایع نیز تغییر میکند. بدینسان یک روش برای نظارت شارژ، نظارت کردن بر چگالی نسبی یا چگالی مایع درون باتری نسبت به آب است.
باتریهای مدرن شامل فلز کلسیم درون سرب هستند تا تمایل برای تولید گاز هیدروژن در خلال شارژ کردن توسط الکترولیز آب در محلول الکترولیت را کاهش دهد. اگر میزان کافی فلز کلسیم موجود باشد، تولید گاز باتری به خوبی کنترل میشود بطوریکه پیلها میتوانند دست نخورده باقی مانده و نیاز آنها برای تعویض آب به مقدار زیادی کاهش مییابد.
نوع معمول دیگر باتریهای قابل شارژ نوع NiCd است که بر پایهی الکتروشیمی نیکل و کادمیم است. چون این دو عنصر شیمی متفاوتی دارند، ولتاژهای متفاوتی نیز دارند. پیلهای خشک، پیلهای سرب/اسید و پیلهای NiCd همگی ولتاژهای متفاوتی از حدود 1.3 volts تا حالت کاملا شارژ 2.1 volts تولید میکنند. باتریهای NiCd عموما بصورت فیزیکی هماندازهی پیلهای خشک کربن/روی هستند و در سایزهای دوبل A و C و دیگر سایزهای معمول ساخته میشوند. ولی آنها ولتاژ متفاوتی دارند که این نوع پایینتر است. معمولا این موضوع برای اکثر وسایل الکترونیکی که در مقابل انرژی داخلی لازم انعطاف پذیر هستند مشکلی به حساب نمیآید.
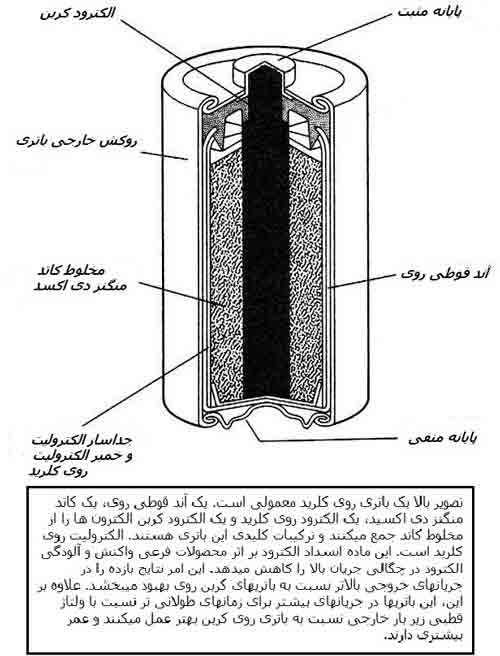
تمامی باتریها یا پیلها دارای یک مقاومت و ظرفیت داخلی هستند. مقاومت داخلی مقدار آمپری که باتری میتواند بطور مطمئن تولید کند را تعیین میکند. ظرفیت در واحد آمپر/ساعت اندازهگیری میشود. ظرفیت به سادگی تعداد آمپرهایی را که باتری میتواند در یک سرعت تخلیهی معقول برای آن باتری تامین کند و تعداد ساعتهایی که انتظار میرود تا این آمپرها را تامین کند، را بیان میکند.
قسمت بعدی >>