زنگ تفریح 212، جان نیولندز، دیمیتری مندلیف، مزایای علمی جدول مندلیف، نقایص جدول مندلیف
<<قسمت قبلی
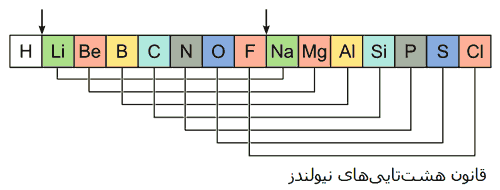
جان نیولندز
جان نیولندز (John Newlands) یک شیمیدان انگلیسی بود که در سال 1865، 56 عنصر شناخته شده تا آن زمان را به 11 گروه بر اساس تشابه خواص فیزیکی تقسیم کرد.
نیولندز به این نکته پی برده بود که جفت عنصرهای مشابهی وجود دارند که اختلاف عدد اتمی آنها ضریبی از عدد 8 میباشد. البته قانون هشتاییهای او (law of octaves) به دلیل اینکه شبیه مقیاس نتهای موسیقی بود، توسط افراد معاصر با او مورد تمسخر قرار گرفت. تا قرن اخیر که به دلیل نظریه پیوند والانس گیلبرت ن.لوییس (Gilbert N. Lewis’ valance bond theory) در سال 1916 و نظریه اوکتت یا هشتایی ایروینگ لانگمور (Irving Langmuir) در سال 1919 اهمیت حالت تناوبی عدد هشت مورد قبول واقع شد.
دیمیتری مندلیف
دیمیتری مندلیف (Dmitri Mendeleev)، شیمیدان روسی، اولین دانشمندی بود که جدولی تناوبی طراحی کرد بسیار مانند آنچه ما امروز استفاده میکنیم. مندلیف عناصر را در یک جدول بر اساس وزن اتمی، مطابق با مقدار تقریبی جرم مولی که امروزه شناخته شده است، تنظیم کرد. بعضی مواقع گفته میشود که او در سفرهای طولانی با قطار "کارت بازی شیمیایی" بازی میکرده است که از کارتهایی استفاده میکرده است که دارای نکات مختلف از عنصرهای شناخته شده بوده است. در 6 مارچ سال 1869 یک ارائهی رسمی برای انجمن شیمی روسیه اجرا شد با عنوان وابستگی میان خواص اوزان اتمی عناصر. (The Dependence Between the Properties of the Atomic Weights of the Elements) جدول او در یک روزنامه گمنام روسی منتشر شد ولی به سرعت در سال 1869 در یک روزنامه آلمانی به نام Zeitschrift für Chemie (به فارسی: مجله شیمی) دوباره منتشر شد. این روزنامه عنوان کرده بود که:
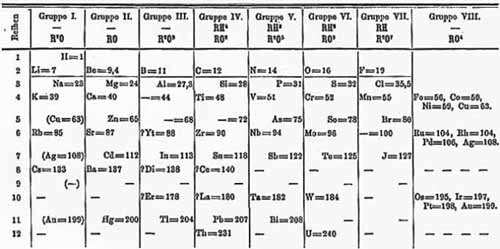
1. عناصر اگر بر اساس وزن اتمیشان مرتب شوند، یک تناوب آشکار از خواص را به نمایش میگزارند.
2. عناصر مشابه با توجه به خواص شیمیایی آنها یا دارای اوزان اتمی نزدیک به هم هستند (مانند Pt، Ir، Os) یا به صورت منظم وزن اتمیشان افزایش مییابد (مانند K، Rb، Cs).
3. آرایش عناصر یا گروههای عناصر بر اساس وزن اتمی، وابسته به یک خصوصیت آنها به نام والانس است و همچنین با توجه به برخی فضاها وابسته به خواص شیمایی خاصه آنها است؛ همانطور که در میان سریهای Li، Be، Ba، C، N، O و Sn نیز مشابه است. (در اصل باید Li، Be، B، C، N، O و F باشد)
|
4. عناصری که به صورت گسترده پخش شدهاند دارای اوزان اتمی کوچک هستند.
5. دامنهی وزن اتمی مشخصات عنصر را تایین میکند، همانند دامنه وزن مولکولی که مشخصات ساختاری ترکیب را مشخص میکند.
6. ما باید انتظار کشف بسیاری از عناصر کشف نشده را داشته باشیم _ برای مثال، عناصر مشابه با آلومینیم و سیلیسیم _ که وزن اتمی آنها میبایست بین 65 تا 75 باشد.
7. وزن اتمی یک عنصر ممکن است گاهی اوقات توسط اطلاعات از عناصر مجاورش اصلاح شود. به این صورت وزن اتمی تلوریم میبایست مابین 123 و 126 باشد و نمیتواند 128 باشد. (این مساله بر اساس مکان تلوریم که بین آنتیموان و ید که دارای وزن اتمی 127 میباشد بیان میشود. البته موزلی بعدها مکان این عناصر را بدون تجدید نظر در مقادیر وزن اتمی توضیح داد)
|
 |
8. خواص مشخص عناصر میتواند توسط اوزان اتمیشان پیش بینی شود.
مزایای علمی جدول مندلیف
|
· مندلیف کشف عناصر دیگر را پیش بینی کرده بود و فضای خالی برای این عناصر در نظر گرفته بود. با نامهای اکا-سیلیسیم (ژرمانیم)، اکا-آلومینیم (گالیم)، و اکا-بور (اسکاندیم). به این صورت هیچ اختلالی در جدول تناوبی وجود نداشت.
· او اشاره کرده بود که بعضی از اوزان اتمی آن زمان نادرست هستند.
· او انحراف از قانون وزن اتمی را نیز فراهم کرده بود.
|

|
نقایص جدول مندلیف
· جدول او دربردارندهی هیچ یک از گازهای نجیب که بعدا کشف شدند نبود. این عناصر توسط سر ولیام رمزی (Sir William Ramsay) به عنوان گروه 0، بدون ایجاد هیچ اختلالی در مفهوم پایهای جدول تناوبی اضافه شدند.
· هیچ مکانی برای ایزوتوپهای عناصر مختلف که بعدا کشف شدند وجود نداشت.
· مکان درستی برای هیدروژن در جدول نتاوبی در نظر گرفته نشده بود. هیدروژن هم میتوانست در گروه فلزات قلیایی و هم در گروه هالوژنها قرار بگیرد. به این صورت، قانون تناوبی دیمیتری مندلیف نمیتوانست یک مکان مناسب برای هیدروژن در نظر بگیرد.
قسمت بعدی>>