زنگ تفریح شماره 92
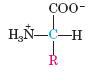
اسیدهای آمینه به عنوان چارچوب تشکیل دهنده ساختار پروتئینها، یکی از مهمترین مولکولهای آلی موجود در روی زمین به حساب میآیند. این مولکولها با ایجاد پیوند پپتیدی و قرارگیری خطی کاملا منظم و برنامهریزی شده درکنار هم منجر به تشکیل ساختار سه بعدی بی همتای موجود در هر پروتئین میشوند که وجود چنین ساختارهای دقیقی، عاملی بسیار کلیدی در عملکرد اختصاصی هر پروتئین است. نام این ترکیبات به دلیل ساختار شیمیایی آنها است، به طوری که این مولکولها دارای ساختار کلی هستند که شامل یک گروه کربوکسیل، یک گروه آمینو، یک اتم هیدروژن و یک گروه جانبی (گروه R) متصل به یک اتم کربن موسوم به کربن آلفا هستند.
 |
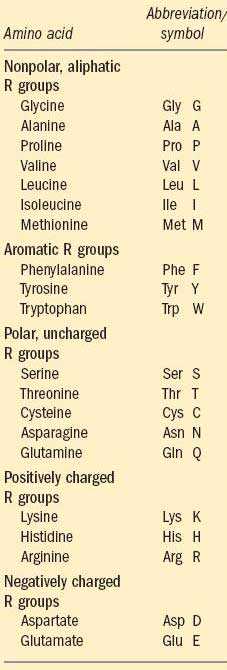
تفاوت اسیدهای آمینه مختلف در ساختار گروه جانبی آنهاست. به طور کلی 20 اسیدآمینه شناسایی شده وجود دارد که برای تشکیل ساختار پروتئینها ضروری هستند. اولین اسید آمینه شناسایی شده، آسپاراژین است که در سال 1806 توسط Louis-Nicolas Vauquelin و Pierre Jean Robiquet از گیاه مارچوبه (Asparagus) جدا شد. آخرین اسید آمینه شناسایی شده نیز تیروزین است که تا سال 1938 شناسایی نشده بود. برای شناسایی آسان این 20 مولکول از علایم اختصاری یک و سه حرفی برای هر اسید آمینه استفاده میشود
 |
این مولکولها از نظر ساختاری خصوصیاتی دارند که آنها را به عنوان تنها نامزد سازنده ساختار پروتئینها مطرح مینماید. وجود گروه آمینو و کربوکسیل در این ترکیبات به عنوان مهمترین خصوصیت ساختاری منحصر به فرد در اسیدهای آمینه منجر به توانایی این مولکولها در رفتارهای اسیدی و بازی شده که این موضوع در عملکرد پروتئینها بسیار مهم است. در یک دید کلی میتوان اسیدهای آمینه را بر اساس خصوصیات گروه جانبی آنها به گروههای مختلف تقسیمبندی نمود:
1- اسیدهای آمینه دارای گروه جانبی غیر قطبی و آلیفاتیک : اسیدهای آمینه این گروه دارای گروه جانبی غیر قطبی آبگریز هستند. آلانین، والین، لوسین و ایزولوسین اسیدهای آمینهای هستند که گروه جانبی آنها در محیط آبی موجود در شرایط معمول بدن تمایل به دوری از مولکولهای آب داشته و به وسیله برهمکنشهای آبگریز مبادرت به تشکیل خوشههای آبگریز در درون پروتئین میدهند.
گلیسین به عنوان کوچکترین اسید آمینه، علیرغم ساختار غیر قطبی خود، به دلیل ساختمان بسیار کوچک خود، نقشی در برهمکنشهای آبگریز ندارد.
متیونین به عنوان یکی از دو اسید آمینه دارای گوگرد در ساختار خود، دارای یک گروه تیواتر غیر قطبی در زنجیر جانبی خود است
پرولین اسید آمینهای است که بر خلاف سایر اسیدهای آمینه، دارای ساختار خاصی بوده و گروه آمینوی آن با اتصال به زنجیر جانبی منجر به کاهش انعطاف پذیری آن شده و بر این اساس از آن در مناطق خاص پروتئینی که نیاز به عدم انطاف پذیری است، استفاده میشود
2- اسیدهای آمینه دارای گروه جانبی حلقوی: این گروه که شامل تیروزین، فنیل آلانین و تریپتوفان است، نسبتا آبگریز هستند. تیروزین به واسطه گروه هیدروکسیل موجود در زنجیر جانبی خود قادر به تشکیل پیوندهای هیدروژنی بوده و بر این اساس به عنوان گروه عملکردی مهم در برخی آنزیمها به شمار میآید. تیروزین به دلیل گروه هیدروکسیلی و تریپتوفان به واسطه نیتروژن موجود در حلقه اندولی خود نسبت به فنیل آلانین، خصوصیات قطبی بالاتری نشان میدهند. یکی از خصوصیات بسیار مهم دو اسید آمینه اول (و با شدت کمتری در فنیل آلانین) توانایی جذب نور ماورا بنفش است
3- اسیدهای آمینه دارای گروه جانبی قطبی فاقد بار: این اسیدهای آمینه به واسطه گروههای جانبی قطبی خود قادر به برهمکنش با مولکولهای آب و تشکیل پیوند هیدروژنی هستند. سرین و ترئونین به واسطه گروه هیدروکسیل، سیستئین به واسطه گروه سولفیدریل، گلوتامین و آسپاراژین به واسطه گروه آمید موجود در زنجیر جانبی خود قادر به برهمکنش با آب هستند. آسپاراژین و گلوتامین به عنوان فرم آمیدی دو اسید آمینه اسیدی آسپارتات و گلوتامات هستند.
دو مولکول سیستئین با تشکیل پیوند دی سولفیدی قادر به اتصال به هم بوده و منجر به تشکیل دیمری به نام سیستین میشود که به شدت آبگریز بوده و به عنوان پیوندی اساسی در ساختار برخی پروتئینها مطرح است (مثل انسولین، به زنگ تفریح شماره 89 مراجعه شود).
4- اسیدهای آمینه دارای گروه جانبی با بار مثبت: این گروه که شامل لیزین، آرژینین و هیستیدین است، در pH معمول بدن دارای بار مثبت هستند. لیزین به واسطه گروه آمینو، آرژینین به واسطه گروه گوانیدین (Guanidino group) و هیستیدین به واسطه گروه ایمیدازول (Imidazole group) خود چنین اثری از خود نشان میدهند.
5- اسیدهای آمینه دارای گروه جانبی با بار منفی: این گروه شامل آسپارتات و گلوتامات بوده و در pH معمول بدن دارای بار منفی هستند که چنین خصوصیتی به واسطه حضور گروه کربوکسیل موجود در زنجیره جانبی آنها ایجاد میشود.