.
تاشدگی پروتئین فرایندی فیزیکی است که در آن بسپپتید (یا پلیپپتید) به ساختار سهبعدی مشخصی پیچیده میشود. هر پروتئین از یکی بسپپتید آغاز میشود. بسپیپیدها زنجیرهای از اسیدهای آمینه هستند که در آغاز هیچ ساختار سهبعدی مشخصی ندارند (سمت چپ شکل روبهرو). ولی هر اسید آمیه در زنجیره میتواند ویژگیهای شیمیایی خاصی بدارد؛ مثلاً آبدوست یا آبگریز یا باردار باشد.
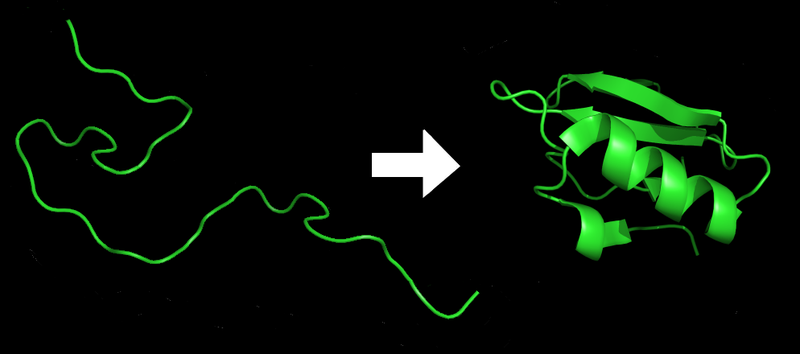
اسیدهای آمینه به خاطر این ویژگیها با یکدیگر و با محیط سلول برهمکنش میکنند و سرانجام ساختار سهبعدی ویژهای را که همان ساختار اصلی پروتئین است به خود میگیرند (سمت راست شکل). این ساختار را ترتیب زنجیرهٔ اسیدهای آمینه تعیین میکنند. سازوکار تاشدگی پروتئین هنوز کاملاً شناخته نشدهاست.
اسیدهای آمینه ازیک گروه آمین و یک گروه کربوکسیل و یک زنجیرهٔ جانبی ساخته شدهاند وبا پیوندهای کوالانسی به هم متصلند. پیوند کوالانسی بین اسیدهای آمینه بسیار محکم است به طوری که امکان جابجایی و چرخیدن به اتمهای N-H و C=O را نمیدهد، اما سایر پیوندها دارای استحکام کمتری بوده و امکان چرخیدن برایشان وجود دارد. این ویژگی باعث میشود پروتئینها خاصیت انعطاف پذیری پیدا کنند و بتوانند تا بخورند.
پروتیینها در اثر تا خوردگی شکل فضایی را ایجاد میکنند که دارای کمترین انرژی است. وقتی پروتئین تا میخورد پیوندهای ضعیف غیر کوالانسی به تثبیت تا خوردگی کمک میکنند. این پیوندها عبارتند از: پیوند یونی، پیوند هیدروژنی، برهمکنشهای واندروالس و نیروهای آب گریز.
همانطور که گفته شد زنجیره جانبی متصل به اسیدهای آمینه میتوانند قطبی یا غیر قطبی باشند. وقتی پروتئین در آب سیتوزولی قرار میگیرد زنجیرههای جانبی آب گریز تمایل دارند بصورت یک مجموعه در درون مولکول پروتئین قرار بگیرند تا حد اقل تماس با مولکولهای قطبی آب را داشته باشند و اثر تضعیف کننده آنها بر پیوندهای هیدروژنی آب حداقل باشد.

از طرف دیگر زنجیرههای جانبی ای که قطبی هستند تمایل دارند که در روی سطح مولکول پروتئین قرار بگیرند و با مولکولهای آب و یا سایر مولکولها پیوند هیدروژنی ایجاد کنند. بنابراین خاصیت آب گریزی زنجیرههای جانبی در تعیین شکل پروتئین نقش اساسی دارد.
در اثر تا خوردن پروتئینها شکل نهایی پیدا میکنند که یکتا و دارای کمینه انرژی است. تمامی اطلاعات لازم برای تا خوردن پروتئین در توالی اسیدهای آمینه آن تهفتهاست. زیرا این توالی منحصر به فرد محل قرارگیری زنجیرهای جانبی را تعیین کرده وشکل نهایی پروتئین را تعیین میکنند.
تا خوردن پروتئین در درون سلول یکی از فرایندهای حیاتی زیستی است. در اثرتا خوردن نا مناسب تجمعاتی ایجاد میشود که میتواند به بافت سلول آسیب برساند. برخی از بیماریهای عصبی مانند آلزایمر و بیماری هانتینگتون در اثر بد تا خوردن پروتئین در بافتهای عصبی ایجاد میشوند.
در فرایند تا خوردن، پروتئین مسیرهایی را از نظر سطح انرژی طی میکند. در ابتدا پروتئین یک رشتهٔ فاقدساختار مشخص با انتروپی بالاست. ضمن فرایند تا خوردن اتمهای ستون فقرات پروتئینی با ایجاد انواع پیوندهای مناسب یا نا مناسب با سایر اتمهای ستون فقرات پروتئینی ویا زنجیره جانبی باعث تغییر در سطح انرژی پروتئین میشوند.
فرایند تا خوردن که درآن پروتئین از حالت تا نخورده به حالت نهایی میرسد را میتوان از دیدگاه آماری بررسی نمود.
میتوان به جای یک پروتئین که فرایند تا خوردن را با تعداد زیادی پیکربندی ممکن از نظر انرژی تجربه میکند یک مجموعه از همه پیکر بندیهای ممکن انرژی در نظر گرفت و تعداد حالتهایی که در آن انرژی مقدار خاصی است را بدست آورد و برای سیستم آنتروپی را محاسبه نمود و به این ترتیب انرژی آزاد گیبس را به دست آورد. حالت نهایی سیستم در کمینه انرژی اتفاق میافتد.
بررسی سیستم از نظر اماری به ما این امکان را میدهد که فرایند نا خوردن را با جزئیات شبیه سازی کنیم و این فرایند را بهتر بشناسیم.
یکی از مباحث جالب درتا خوردن پروتئین، مسئله زمان تا خوردن است. مدت زمان لازم برای این فرایند در درون سلول از مرتبه ثانیهاست. نخستین بار لوینتال با محاسبه پارامتر سرعت واکنش از رابطه آرنیوس مدت زمان لازم برای تا خوردن پروتئین را محاسبه کرد. وی این زمان را با در نظر گرفتن تمامی مسیرهای ممکن انرژی انجام داد وجوابی که بدست آورد یک عدد نجومی بود.
لوینتال نتیجه گرفت که در فرایند تا خوردن پروتئین، همه مسیرهای ممکن انرژی طی نمیشوند و مسیر ویژهای برای تا خوردن وجود دارد.
تعیین ساختار سهبعدی پروتئین به طور تجربی بسیار دشوار است. ولی ترتیب زنجیرهٔ هر پروتئین معمولاً دانستهاست. پژوهشگران میکوشند روشهای زیستفیزیکی گوناگون را به کار بگیرند تا ساختار سهبعدی نهایی را از روی دنبالهٔ اسیدهای آمینه پیشبینی کنند.
بسیاری از پروتئینها برای کار حتماً باید ساختار سهبعدی درست خود را بدارند. معمولاً اگر پروتئینی نتواند به ساختار درست خود تا شود، غیرفعال میشود.