مشاهدهی علمی شماره 71

اصل لوشاتلیه مهمترين اصل در سينتيك شيميايي است كه در سال 1884 توسط هنري لوشاتليه (1936-1850)، شيميدان فرانسوي ارائه شد. اين اصل بيان ميكند كه اگر تنشي در يك سيستمِ در حال تعادل ايجاد شود، سيستم با اين تنش مقابله كرده و تعادل جديدي در جهت تعدیل آن تنش، برقرار ميكند. در این مبحث با ارائهی واکنشی نمایشی این اصل توضیح داده شده است و در پایان به رابطهی اصل لوشاتلیه با حیات انسان اشاره شده است.
| مواد و وسایل لازم |
♦ بالن سه دهانه 500 میلیلیتری
♦ 200 میلیلیتر از محلول اتانولی 1/0 مولار کلرید مس (II) دو آبه
♦ همزن مغناطیسی
♦ 150 میلیلیتر اسید هیدروکلرید غلیظ
♦ 150 میلیلیتر آب مقطر
♦ صفحه همزن مغناطیسی |
200 میلیلیتر از محلول اشباع کلرید مس (II) 1/0 مولار در اتانول را به یک بالن سه دهانهی 500 میلیلیتری اضافه کنید و یک عدد همزن مغناطیسی به داخل بالن بیاندازید تا توسط همزن مغناطیسی خوب هم زده شود. محلول اتانولی کلرید مس (II) به رنگ سبز است. سپس 150 میلیلیتر آب مقطر به بالن در حال هم زده شدن اضافه کنید. با افزودن آب به آن، رنگ آبی ظاهر میشود. در ادامه 150 میلیلیتر اسید هیدروکلرید غلیظ به محتوی بالن بیافزایید. ملاحظه میکنید که با افزایش هیدروکلریک اسید غلیظ به آن، مجددا رنگ سبز در محلول ظاهر میشود. محلول موردنظر میتواند چندین بار بهطور متناوب با افزودن آب و اسید تغییر رنگ دهد. این تغییرات در رنگ، بهوضوح دیده در شکل 1 میشود.

شکل 1
در این واکنش هیجانانگیز تعادل زیر برقرار است.
-CuCl42-(green) + 4 H2O ⇔ Cu(H2O)42+(blue) + 4 Cl
این تعادل شاید یکی از بهترین واکنشها برای بحث در مورد اصل لوشاتلیه در شیمی عمومی است. اما این سیستم بهخاطر تشکیل کمپلکسهای ترکیبی قدری پیچیده شده است. افزایش آب به سیستم، واکنش را بهسمت راست یعنی تشکیل کمپلکس آبی رنگ +Cu(H2O)42، جابهجا میکند و نهایتا رنگ آبی در محلول ظاهر میشود. بهمحض افزایش اسید هیدروکلرید غلیظ تعادل بهدلیل ازدیاد یون -Cl در جهت مصرف آن، یعنی به سمت چپ میل میکند. که نهایتا این جابهجایی در تعادل بهصورت تغییر رنگ سبز بهدلیل افزایش کمپلکس -CuCl42 به چشم دیده میشود.
| |
اصل لوشاتلیه و حیات انسان |
هموگلوبین، پروتئینی در خون ما انسانهاست که کار انتقال اکسیژن به سلولهای بدن را انجام میدهد. در واکنش تعادلی زیر (شکل 2) نحوهی ترکیب پروتئین هموگلوبین (Hb) با چهار اتم اکسیژن خون برای اکسیژنرسانی به بافتهای بدن نشان داده شده است.
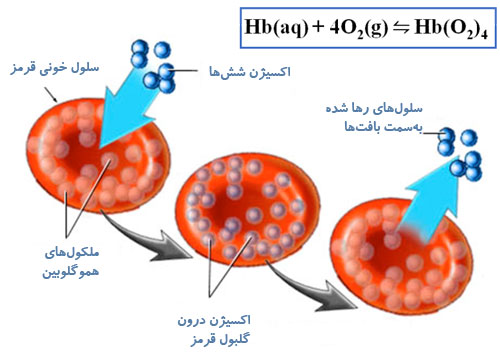
شکل 2
در غلظت بالای اکسیژن، تعادل ترکیب شدن هموگلوبین با اکسیژن بهخوبی انجام میشود و اکسیژن لازم به تمام بافتهای بدن میرسد. اما در شرایطی که اکسیژن هوا کاهش مییابد مانند زمانی که برای کوهنوردی به قلهی کوه میروید، بهدلیل کاهش فشار هوا، میزان اکسیژن پایین است. بنابراین طبق اصل لوشاتلیه تعادل به سمت چپ در جهت تولید اکسیژن بیشتر جابهجا میشود در نتیجه اکسیژن کمتری به بافتهای بدن به دلیل کاهش میل ترکیبی پروتئین هموگلوبین با اکسیژن هوا، میرسد که علت تاری دید و سرگیجه در ارتفاعات هم به همین خاطر است.
منابع:
http://chemdemos.uoregon.edu/
http://chemwiki.ucdavis.edu/
نویسنده: عاطفه قویدست
دانشجوی سال دوم دکتری شیمی آلی
دانشگاه گیلان