مفاهیم کلیدی: فیزیک، نقطه ی جوش، کندانسیون، تقطیر
مشاهده علمی ۱۸۲


مقدمه:
آیا به آشپزی علاقه دارید؟ اگر در خانه هنگام آشپزی به بزرگتر خود کمک کرده باشید یا آشپزی کسی را تماشا کرده باشید، به احتمال زیاد مایعات فراوانی را دیدهاید که داغ میشوند، مانند شیر، آب و ... . آیا دقت کردهاید که با جوشیدن مایع، بخار زیادی تولید میشود؟ تا به حال به این فکر کردهاید که بخار از چه چیزی ساخته شده است و چه اتفاقی برای شکر و نمک حل شده در مایع رخ میدهد؟ آیا این مواد نیز میجوشند یا در محلول باقی میمانند؟ در این فعالیت علمی شما یک دستگاه تقطیر خواهید ساخت که امکان نمونهبرداری از بخار تولید شده از یک آبمیوهی در حال جوشیدن را فراهم میکند. به نظرتان این بخار چه مزه ای دارد؟
پیشزمینه:
برای ساخت یک محلول به چه چیزهایی نیاز دارید؟ اول از همه آب (حلال) و سپس مادهای مانند شکر یا نمک که در آن حل شود (حل شونده). حلال و حل شونده تشکیل یک محلول میدهند که در واقع مخلوطی همگن است و شما نمیتوانید این دو جزء را در آن از هم تشخیص دهید. بسیاری از محلولها حاوی مواد مختلفی هستند، اما چگونه میتوان این اجزا را در یک محلول مایع از هم جدا کرد؟ فرآیندی به نام تقطیر امکان انجام این کار را فراهم میکند. تقطیر کاربردهای زیادی در دنیای واقعی دارد، از جمله در داروسازی، عطرسازی و یا تولید برخی محصولات غذایی.
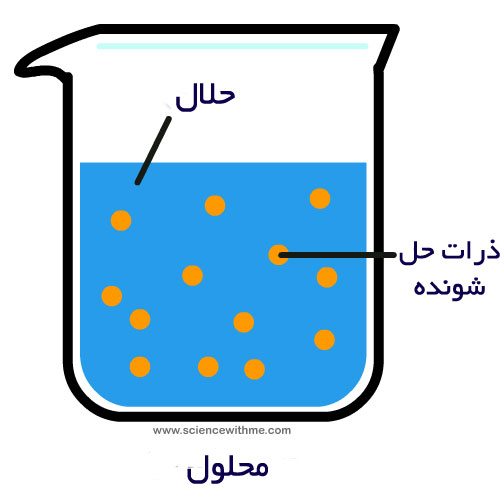
تقطیر از تفاوت در فراریت اجزای محلول استفاده میکند، به این معنا که هر ترکیب نقطهی جوش متفاوتی دارد و در درجه حرارت خاص به خود شروع به تبخیر میکند (تغییر از حالت مایع به گاز). در هنگام تقطیر محلول گرم میشود تا جزء دارای پایینترین نقطهی جوش اول از همه تبخیر شود و اجزای دیگر در محلول باقی بمانند. جزء تبخیر شده که در حالت گازی قرار دارد را می-توان سپس با کندانسیون در ظرفی دیگر جمعآوری کرد. این فرآیند تقطیر نام دارد، بدان معنا که بخار تا اندازهای سرد میشود که گاز مجدداً به مایع تغییر حالت دهد. با تغییر دمای تقطیر شما میتوانید بسیاری از مواد را با توجه به فراریتشان جداسازی کنید. با این وجود اگر محلولی داشته باشید که حاوی حل شوندهی غیر فرار باشد، این جزء در فرآیند تقطیر در محلول باقی میماند.
حال با علم به نحوهی کار دستگاه تقطیر، به نظرتان با جوشاندن آب میوه چه اتفاقی میافتد؟ دستگاه تقطیر خود را بسازید و این موضوع را بررسی کنید.
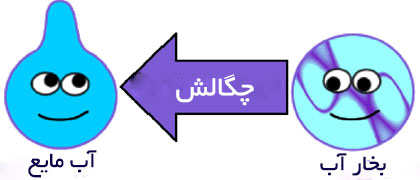
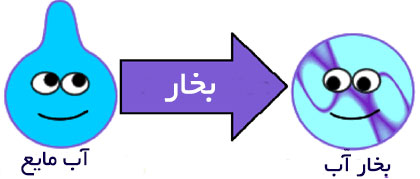
توضیح: پدیده ی چگالش برای تمامی حالت های انقباضی و تراکم به کار می رود. در فارسی و عربی از واژه ی میعان دقیقا برای همین کلمه ولی در مورد تبدیل بخار به آب استفاده می شود.
مواد و وسایل مورد نیاز:
 اجاق گاز (همیشه در هنگام کار با اجاق گاز از یک بزرگتر کمک بگیرید.)
اجاق گاز (همیشه در هنگام کار با اجاق گاز از یک بزرگتر کمک بگیرید.)
 قابلمهی عمیق با در شیبدار (در صورت امکان در شفاف باشد)
قابلمهی عمیق با در شیبدار (در صورت امکان در شفاف باشد)
 کاسهی سرامیکی
کاسهی سرامیکی
 یک بشقاب سرامیکی کوچک یا فنجان سرامیکی
یک بشقاب سرامیکی کوچک یا فنجان سرامیکی
 سه عدد لیوان شیشهای
سه عدد لیوان شیشهای
 آب سیب یا آب آلبالو (حدود نیم لیتر)
آب سیب یا آب آلبالو (حدود نیم لیتر)
 پیمانهی اندازهگیری مایع
پیمانهی اندازهگیری مایع
 یخ
یخ
 دستگیرهی آشپزخانه
دستگیرهی آشپزخانه
 عصارهی گوشت (اختیاری)
عصارهی گوشت (اختیاری)
 دماسنج (اختیاری)
دماسنج (اختیاری)
 سرکه (اختیاری)
سرکه (اختیاری)
آمادهسازی:
 دقت کنید که تمام وسایل مورد استفاده کاملاً تمیز باشند. (در این صورت میتوانید از آب میوه و سایر مواد در انتهای کار نمونهبرداری کنید و آنها را بچشید.)
دقت کنید که تمام وسایل مورد استفاده کاملاً تمیز باشند. (در این صورت میتوانید از آب میوه و سایر مواد در انتهای کار نمونهبرداری کنید و آنها را بچشید.)
 بشقاب سرامیکی کوچک را در وسط قابلمه قرار دهید. بسته به عمق قابلمه میتوانید یک فنجان سرامیکی نیز در مرکز آن بگذارید.
بشقاب سرامیکی کوچک را در وسط قابلمه قرار دهید. بسته به عمق قابلمه میتوانید یک فنجان سرامیکی نیز در مرکز آن بگذارید.
 یک کاسهی سرامیکی را روی بشقاب کوچک یا فنجان بگذارید.
یک کاسهی سرامیکی را روی بشقاب کوچک یا فنجان بگذارید.
 حال قابلمه را روی اجاق گاز قرار دهید.
حال قابلمه را روی اجاق گاز قرار دهید.

روش کار:
 یک پیمانه آب میوه داخل یک لیوان بریزید. به رنگ آن نگاه کنید و مقدار کمی از آن را بچشید، شیرین است؟ رنگ آب میوه چطور، آیا پررنگ است؟ باقی آب میوه را برای مقایسه در انتهای کار نگه دارید.
یک پیمانه آب میوه داخل یک لیوان بریزید. به رنگ آن نگاه کنید و مقدار کمی از آن را بچشید، شیرین است؟ رنگ آب میوه چطور، آیا پررنگ است؟ باقی آب میوه را برای مقایسه در انتهای کار نگه دارید.
 یک پیمانه آب میوهی رنگی در کف قابلمه بریزید. (در این حالت بشقاب کوچک یا فنجان سرامیکی شما در میان آب میوه قرار میگیرد.)
یک پیمانه آب میوهی رنگی در کف قابلمه بریزید. (در این حالت بشقاب کوچک یا فنجان سرامیکی شما در میان آب میوه قرار میگیرد.)
 با کمک گرفتن از بزرگتر خود شعلهی زیر قابلمه را روشن کنید و حرارتی متوسط به آن بدهید تا آب میوه بجوشد. آیا با شروع جوشیدن بخار تولید شده را مشاهده میکنید؟
با کمک گرفتن از بزرگتر خود شعلهی زیر قابلمه را روشن کنید و حرارتی متوسط به آن بدهید تا آب میوه بجوشد. آیا با شروع جوشیدن بخار تولید شده را مشاهده میکنید؟
 حال در قابلمه را برعکس روی آن بگذارید، به طوری که نوک در به سمت پایین و کاسهی سرامیکی داخل قابلمه باشد. با بستن در به این شکل چه اتفاقی برای بخار تولید شده میافتد؟
حال در قابلمه را برعکس روی آن بگذارید، به طوری که نوک در به سمت پایین و کاسهی سرامیکی داخل قابلمه باشد. با بستن در به این شکل چه اتفاقی برای بخار تولید شده میافتد؟
 روی در برعکس یک تکه یخ قرار دهید. در طول آزمایش با ذوب شدن این تکه باید یخ دیگری جایگزین آن کنید. اگر از در شفاف استفاده کرده باشید، میتوانید قطرههای تشکیل شده در سطح داخلی در را مشاهده کنید. این قطرات از کجا میآیند و چه اتفاقی برایشان میافتد؟
روی در برعکس یک تکه یخ قرار دهید. در طول آزمایش با ذوب شدن این تکه باید یخ دیگری جایگزین آن کنید. اگر از در شفاف استفاده کرده باشید، میتوانید قطرههای تشکیل شده در سطح داخلی در را مشاهده کنید. این قطرات از کجا میآیند و چه اتفاقی برایشان میافتد؟
 محتویات قابلمه را به مدت بیست تا سی دقیقه بجوشانید و دقت داشته باشید که مقداری آب میوه باید همواره در کف ظرف باقی بماند. با گذشت زمان آیا تغییری در مقدار آب میوهی داخل قابلمه مشاهده میکنید؟
محتویات قابلمه را به مدت بیست تا سی دقیقه بجوشانید و دقت داشته باشید که مقداری آب میوه باید همواره در کف ظرف باقی بماند. با گذشت زمان آیا تغییری در مقدار آب میوهی داخل قابلمه مشاهده میکنید؟
 پس از گذشت بیست تا سی دقیقه، شعله را خاموش کنید و اجازه دهید ظرف چند دقیقه سرد شود.
پس از گذشت بیست تا سی دقیقه، شعله را خاموش کنید و اجازه دهید ظرف چند دقیقه سرد شود.
 دستگیرههای آشپزخانه را بردارید و با دقت در قابلمه را از روی آن جدا کنید. چه اتفاقی برای کاسهی سرامیکی که داخل قابلمه قرار داده بودید افتاده است؟
دستگیرههای آشپزخانه را بردارید و با دقت در قابلمه را از روی آن جدا کنید. چه اتفاقی برای کاسهی سرامیکی که داخل قابلمه قرار داده بودید افتاده است؟
 با دستگیره کاسهی سرامیکی را از روی بشقاب کوچک یا فنجان بلند کنید و آن را روی یک سطح مقاوم در برابر حرارت بگذارید.
با دستگیره کاسهی سرامیکی را از روی بشقاب کوچک یا فنجان بلند کنید و آن را روی یک سطح مقاوم در برابر حرارت بگذارید.
 بشقاب کوچک یا فنجان سرامیکی را از داخل ظرف بیرون بیاورید. چه مقدار آب میوه در مقایسه با مقداری که ابتدا در قابلمه ریخته بودید باقی مانده است؟
بشقاب کوچک یا فنجان سرامیکی را از داخل ظرف بیرون بیاورید. چه مقدار آب میوه در مقایسه با مقداری که ابتدا در قابلمه ریخته بودید باقی مانده است؟
 پس از سرد شدن قابلمه، آب میوهی باقی مانده در ته قابلمه را داخل یک لیوان بریزید. آیا آب میوه در اثر جوشیدن تغییری کرده است؟
پس از سرد شدن قابلمه، آب میوهی باقی مانده در ته قابلمه را داخل یک لیوان بریزید. آیا آب میوه در اثر جوشیدن تغییری کرده است؟
 مادهی تقطیر شدهی سرد (بخار کندانس شده) را که اکنون مایع داخل کاسهی کوچک است در یک لیوان بریزید. ظاهر این ماده چگونه است؟
مادهی تقطیر شدهی سرد (بخار کندانس شده) را که اکنون مایع داخل کاسهی کوچک است در یک لیوان بریزید. ظاهر این ماده چگونه است؟
 حال لیوان حاوی آب میوه که از ابتدای کار نگه داشته بودید را در کنار دو لیوان جدید بگذارید. ظاهر این مواد را با هم مقایسه کنید. آیا انتظار چنین نتایجی را داشتید؟ به نظرتان چرا آب میوه به این شکل تغییر کرده است؟ چه مقدار آب میوه در مقایسه با مقدار اولیه در قابلمه باقی مانده است؟
حال لیوان حاوی آب میوه که از ابتدای کار نگه داشته بودید را در کنار دو لیوان جدید بگذارید. ظاهر این مواد را با هم مقایسه کنید. آیا انتظار چنین نتایجی را داشتید؟ به نظرتان چرا آب میوه به این شکل تغییر کرده است؟ چه مقدار آب میوه در مقایسه با مقدار اولیه در قابلمه باقی مانده است؟
 اجازه دهید این مایعات به دمای اتاق برسند. به دلیل استفاده از وسایل تمیز و مادهی قابل خوردن (آب میوه) میتوانید مزهی هر محلول را بچشید. این سه محلول چه تفاوتی در مزه با هم دارند؟ کدام شیرینتر و کدام بیمزهتر است؟ بخار کندانس شده چه مزهای دارد؟ این تفاوت از کجا ناشی میشود؟
اجازه دهید این مایعات به دمای اتاق برسند. به دلیل استفاده از وسایل تمیز و مادهی قابل خوردن (آب میوه) میتوانید مزهی هر محلول را بچشید. این سه محلول چه تفاوتی در مزه با هم دارند؟ کدام شیرینتر و کدام بیمزهتر است؟ بخار کندانس شده چه مزهای دارد؟ این تفاوت از کجا ناشی میشود؟
 در انتها مادهی تقطیر شده را به لیوان حاوی آب میوهی باقی مانده در قابلمه اضافه کنید. آیا حجم مایع به چیزی که در ابتدا اضافه کرده بودید میرسد؟ ظاهر و طعم این محلول چه تفاوتی با آب میوهی اصلی دارد؟
در انتها مادهی تقطیر شده را به لیوان حاوی آب میوهی باقی مانده در قابلمه اضافه کنید. آیا حجم مایع به چیزی که در ابتدا اضافه کرده بودید میرسد؟ ظاهر و طعم این محلول چه تفاوتی با آب میوهی اصلی دارد؟
آزمایشهای تکمیلی:
 این فعالیت علمی را با استفاده از یک محلول شور مانند عصارهی گوشت انجام دهید. به نظرتان نتایج یکسان خواهد بود؟ در هنگام جوشیدن عصارهی گوشت چه اتفاقی برای نمک داخل آن میافتد؟
این فعالیت علمی را با استفاده از یک محلول شور مانند عصارهی گوشت انجام دهید. به نظرتان نتایج یکسان خواهد بود؟ در هنگام جوشیدن عصارهی گوشت چه اتفاقی برای نمک داخل آن میافتد؟
 این فعالیت علمی را با سرکه تکرار کنید. سرکه مخلوطی حاوی چهار تا شش درصد استیک اسید به اضافهی آب است. آیا می-توانید با تقطیر این دو مایع را از هم جدا کنید؟ در این صورت مادهی تقطیر شده چه طعمی دارد؟
این فعالیت علمی را با سرکه تکرار کنید. سرکه مخلوطی حاوی چهار تا شش درصد استیک اسید به اضافهی آب است. آیا می-توانید با تقطیر این دو مایع را از هم جدا کنید؟ در این صورت مادهی تقطیر شده چه طعمی دارد؟
 احتمالاً میدانید که نقطهی جوش آب خالص در فشار اتمسفر طبیعی ۱۰۰ درجه سلسیوس (۲۱۲ فارنهایت) است. اضافه کردن یک جزء حل شونده به آب مانند نمک، شکر و غیره سبب تغییر در نقطه جوش محلول حاصل میشود. سه محلول خود را گرم کنید (آب میوهی اصلی، آب میوهی باقی مانده در قابلمه و مادهی تقطیر شده) و نقطهی جوش هر یک را با دماسنج اندازه بگیرید. نقطهی جوش آنها چه میزان متفاوت است؟ با افزایش غلظت حل شونده، نقطهی جوش محلول چه تغییری میکند؟
احتمالاً میدانید که نقطهی جوش آب خالص در فشار اتمسفر طبیعی ۱۰۰ درجه سلسیوس (۲۱۲ فارنهایت) است. اضافه کردن یک جزء حل شونده به آب مانند نمک، شکر و غیره سبب تغییر در نقطه جوش محلول حاصل میشود. سه محلول خود را گرم کنید (آب میوهی اصلی، آب میوهی باقی مانده در قابلمه و مادهی تقطیر شده) و نقطهی جوش هر یک را با دماسنج اندازه بگیرید. نقطهی جوش آنها چه میزان متفاوت است؟ با افزایش غلظت حل شونده، نقطهی جوش محلول چه تغییری میکند؟
مشاهده و نتیجهگیری:
آب میوهها معمولاً بسیار شیرین هستند زیرا میوهها حاوی مقدار زیادی قند میوه به نام فروکتوز هستند. با این حال بیش از هشتاد درصد از اکثر میوهها را آب تشکیل میدهد. در نتیجه اساساً آب سیب یا آب آلبالو ترکیبی از آب و شکر است. با رسیدن به نقطهی جوش آب میوه، تبخیر شروع میشود و بخاری از ظرف خارج میشود. اگر در قابلمه را بگذارید بخار تا در بالا میآید و چون در قابلمه بسیار سردتر از بخار است (به خصوص با قرار دادن یخ روی آن) بخار به سرعت سرد و کندانس میشود و مجدداً به حالت مایع درمیآید (قطراتی که روی سطح داخلی در قابلمه تشکیل میشوند). این قطرهها به داخل کاسه سقوط میکنند. با جوشیدن آب میوه احتمالاً متوجه شدهاید که مقدار آب داخل کاسه افزایش و مقدار آب میوهی داخل قابلمه کاهش مییابد. دلیل آن است که بخار که جزئی از آب میوه است در ظرفی جدا جمعآوری میشود. اگر این دو جزء را مجدداً با هم مخلوط کنید حجم به دست آمده برابر با حجمی است که در ابتدا به قابلمه اضافه کردهاید.
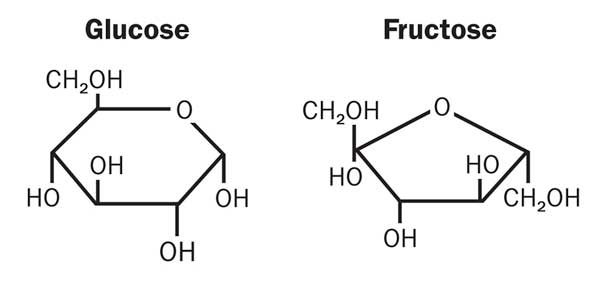
با مقایسهی سه محلول در انتهای کار (آب میوهی اصلی، مادهی تقطیر شده و آب میوهی باقی مانده) اولین چیزی که متوجه آن میشوید این است که رنگ آب میوهی باقی مانده در قابلمه بسیار تیرهتر است و مادهی تقطیر شده کاملاً بی رنگ و شبیه به آب خالص است. در واقع مادهی تقطیر شده آب خالص است و هیچ مزهای ندارد، در حالی که آب میوهی باقی مانده بسیار شیرینتر از آب میوهی اصلی است. دلیل آن است که شکر یک جزء غیر فرار است، بدان معنا که با جوشاندن یک مایع شیرین، شکر باقی میماند و به حالت گاز درنمیآید. جزء آب در مخلوط در دمای صد درجه سلسیوس شروع به جوشیدن میکند و بخاری متشکل از آب خالص ایجاد میکند. نمک هم یک مادهی غیر فرار است و اگر همین فعالیت را با عصارهی گوشت انجام دهید، مادهی تقطیر شده آب خالص است. با مقایسهی نقطهی جوش سه محلول در انتهای کار احتمالاً مشاهده کردهاید که با افزایش مادهی حل شونده به آب نقطهی جوش محلول بیشتر میشود. هر چه مقدار حل شونده بیشتر باشد نقطهی جوش محلول نیز بالاتر می رود.
از سوی دیگر سرکه (ترکیب چهار تا شش درصدی استیک اسید به اضافهی آب) به آسانی قابل جداسازی با فرآیند تقطیر نیست. دلیل آن است که نقطهی جوش آب (۱۰۰ درجهی سلسیوس) و سرکه (۱۰۰.۶ درجه سلسیوس) بسیار به هم نزدیک هستند و جداسازی کامل این دو جزء بدین شکل امکان پذیر نیست. با این توضیحات باید مشاهده کرده باشید که مادهی تقطیر شده آب خالص نیست و همچنان طعم سرکه را دارد.
منبع:
تقطیر
منابع مفید: