مفاهیم کلیدی: مواد شیمیایی، فلز، آتش، اتم، انرژی
مشاهده علمي ۱۴۰

مقدمه:
آیا تا به حال آتشبازیها را تماشا کردهاید؟ چگونه این رنگهای جذاب قرمز، زرد، آبی، بنفش، سبز و ... به وجود میآیند؟ رنگ یا رنگهایی که این آتشبازیها تولید میکنند به مواد شیمیایی ایجاد کنندهی رنگی که در آنها استفاده میشود وابسته است. این مواد شیمیایی فلزات مختلفی هستند که در زمان سوختن رنگهای زیبا تولید میکنند. فلزات مختلف رنگهای متفاوت و خاصی ایجاد میکنند. در این فعالیت علمی شما چند فلز در منزل میسوزانید تا در مورد رنگهایی که تولید میکنند تحقیق کنید. با این کار میتوانید از این پس در مورد دلیل ایجاد رنگها در آتشبازیها برای دوستان و افراد خانوادهی خود توضیح دهید.
پیشزمینه:
اخترشناسان میتوانند با توجه به اینکه هر ستاره چه نوری از خود ساتع میکند، به ترکیبات سازندهی ستارههای دوردست (یعنی ترکیب اتمی آنها) پی ببرند. در این فعالیت علمی شما کاری مشابه را با بررسی رنگ شعلههای مواد شیمیایی مختلف در حال سوختن انجام خواهید داد. اما چرا این رنگها در اثر سوختن تولید میشود؟ دلیل به اتمها و انرژی مربوط میشود.
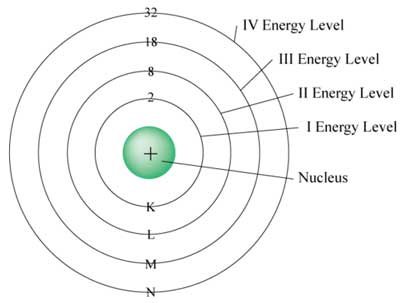
همهی مواد از اتم ساخته شدهاند. اتمها دارای هستههایی احاطه شده توسط الکترونها هستند. الکترونها در حرکت خود به دور هسته مقادیر مشخصی انرژی به نام سطوح انرژی دارند. اگر الکترونها انرژی بیشتری دریافت کنند، از سطح انرژی خود به سطح انرژی بالاتر (پلههای بالاتر) میروند. به همین ترتیب اگر الکترونها انرژی از دست بدهند به سطوح انرژی پایینتر میروند. انرژی از دست رفته میتواند به شکل گرما یا نور (فوتون) منتقل شود. مقدار دقیق انرژی از دست رفته نوع نوری که ساتع میشود را تعیین میکند و در نتیجه ما نور را در رنگهای مختلف میبینیم.
مواد و وسایل مورد نیاز:
 یک بزرگتر برای کمک
یک بزرگتر برای کمک
 نمک آشپزخانه (نام شیمیایی آن سدیم کلرید است)
نمک آشپزخانه (نام شیمیایی آن سدیم کلرید است)
 یک کیسهی پلاستیکی کوچک
یک کیسهی پلاستیکی کوچک
 شش عدد سیخ کباب چوبی کوچک
شش عدد سیخ کباب چوبی کوچک
 چسب سفید
چسب سفید
 سولفات مس (این ماده در مغازههای آکواریوم فروشی برای از بین بردن جلبکها در دسترس است. دقت کنید که این ماده باید خالص و به صورت پودر یا قطعات کوچک کریستالی باشد.)
سولفات مس (این ماده در مغازههای آکواریوم فروشی برای از بین بردن جلبکها در دسترس است. دقت کنید که این ماده باید خالص و به صورت پودر یا قطعات کوچک کریستالی باشد.)
 کبریت یا فندک
کبریت یا فندک
 شمع (شمعی را انتخاب کنید که بتوانید آن را روی یک سطح به شکل ایستاده بگذارید. اگر شمع مورد نظرتان این قابلیت را ندارد، از یک جاشمعی برای نگه داشتن آن استفاده کنید.)
شمع (شمعی را انتخاب کنید که بتوانید آن را روی یک سطح به شکل ایستاده بگذارید. اگر شمع مورد نظرتان این قابلیت را ندارد، از یک جاشمعی برای نگه داشتن آن استفاده کنید.)
 یک سطح در فضای باز (جایی که بتوانید پس از تاریک شدن هوا در آن به راحتی شمع را روشن کنید. دقت کنید که این محل حتماً در معرض جریان هوای مناسب باشد.)
یک سطح در فضای باز (جایی که بتوانید پس از تاریک شدن هوا در آن به راحتی شمع را روشن کنید. دقت کنید که این محل حتماً در معرض جریان هوای مناسب باشد.)
 یک ظرف حاوی آب
یک ظرف حاوی آب
 دستکش یک بار مصرف (برای کار با سولفات مس حتماً باید از دستکش استفاده کنید.)
دستکش یک بار مصرف (برای کار با سولفات مس حتماً باید از دستکش استفاده کنید.)
 داشتن عینک ایمنی توصیه میشود.
داشتن عینک ایمنی توصیه میشود.
 چراغ قوه (اختیاری)
چراغ قوه (اختیاری)
آمادهسازی:
 مقدار کمی نمک آشپزخانه (در حدود یک قاشق غذاخوری) داخل کیسهی پلاستیکی بریزید.
مقدار کمی نمک آشپزخانه (در حدود یک قاشق غذاخوری) داخل کیسهی پلاستیکی بریزید.
 در حدود یک اینچ از سر سیخ کباب را با یک لایهی نازک از چسب آغشته کنید. مقداری بسیار کم چسب کافی است.
در حدود یک اینچ از سر سیخ کباب را با یک لایهی نازک از چسب آغشته کنید. مقداری بسیار کم چسب کافی است.
 سر چسب زدهی سیخ کباب را داخل کیسهی حاوی نمک ببرید. سیخ را در داخل کیسه به جلو و عقب بچرخانید تا تمام قسمت چسبدار از نمک پوشیده شود. سپس سیخ کباب را در جایی بگذارید تا سر آن خشک شود. همین کار را با دو سیخ کباب دیگر نیز انجام دهید تا در نهایت سه سیخ با سر پوشیده شده از نمک داشته باشید.
سر چسب زدهی سیخ کباب را داخل کیسهی حاوی نمک ببرید. سیخ را در داخل کیسه به جلو و عقب بچرخانید تا تمام قسمت چسبدار از نمک پوشیده شود. سپس سیخ کباب را در جایی بگذارید تا سر آن خشک شود. همین کار را با دو سیخ کباب دیگر نیز انجام دهید تا در نهایت سه سیخ با سر پوشیده شده از نمک داشته باشید.
 حال از یک بزرگتر بخواهید سر سه سیخ کباب دیگر را به سولفات مس آغشته کند. تمام اقدامات ایمنی در مورد کار با سولفات مس را که روی بستهی آن نوشته است رعایت کنید. مراقب باشید که هیچ کس گرد سولفات مس را استنشاق نکند و همچنین این ماده با پوست بدن و صورت هیچ کس تماس نداشته باشد. برای ایمنی بیشتر در کار با سولفات مس، از دستکش و عینک ایمنی استفاده کنید. اگر از دستکش استفاده نمیکنید، به هیچ وجه مستقیم به سولفات مس دست نزنید. حال یک اینچ از سر سیخ کباب را با لایهای نازک از چسب بپوشانید و سپس آن را داخل کیسهی حاوی سولفات مس آبی رنگ ببرید. آن را به خوبی به عقب و جلو بچرخانید تا تمام قسمت چسبدار به سولفات مس آغشته شود. این کار را با دو سیخ کباب دیگر نیز انجام دهید تا در نهایت سه سیخ پوشیده شده از سولفات مس داشته باشید.
حال از یک بزرگتر بخواهید سر سه سیخ کباب دیگر را به سولفات مس آغشته کند. تمام اقدامات ایمنی در مورد کار با سولفات مس را که روی بستهی آن نوشته است رعایت کنید. مراقب باشید که هیچ کس گرد سولفات مس را استنشاق نکند و همچنین این ماده با پوست بدن و صورت هیچ کس تماس نداشته باشد. برای ایمنی بیشتر در کار با سولفات مس، از دستکش و عینک ایمنی استفاده کنید. اگر از دستکش استفاده نمیکنید، به هیچ وجه مستقیم به سولفات مس دست نزنید. حال یک اینچ از سر سیخ کباب را با لایهای نازک از چسب بپوشانید و سپس آن را داخل کیسهی حاوی سولفات مس آبی رنگ ببرید. آن را به خوبی به عقب و جلو بچرخانید تا تمام قسمت چسبدار به سولفات مس آغشته شود. این کار را با دو سیخ کباب دیگر نیز انجام دهید تا در نهایت سه سیخ پوشیده شده از سولفات مس داشته باشید.
 اجازه دهید شش سیخ به طور کامل خشک شوند. برای خشک شدن کامل ممکن است حدود نیم ساعت زمان لازم باشد.
اجازه دهید شش سیخ به طور کامل خشک شوند. برای خشک شدن کامل ممکن است حدود نیم ساعت زمان لازم باشد.
 برای سوزاندن این سیخهای کباب لازم است که حتماً در فضای باز باشید. همچنین دقت کنید که در حین سوختن سیخها دود حاصل از سوختن سولفات مس را تنفس نکنید.
برای سوزاندن این سیخهای کباب لازم است که حتماً در فضای باز باشید. همچنین دقت کنید که در حین سوختن سیخها دود حاصل از سوختن سولفات مس را تنفس نکنید.
 در هنگام سوزاندن این سیخها و کار با مس سولفات حضور و نظارت یک بزرگتر الزامی است.
در هنگام سوزاندن این سیخها و کار با مس سولفات حضور و نظارت یک بزرگتر الزامی است.

روش کار:
 زمانی که هوا تاریک است شمع، کبریت و سیخهای آمادهی خود را به فضای باز در جایی برید که بتوانید به راحتی شمع را روشن کنید. مطمئن شوید که جریان هوا در آن محل مناسب است و در طول انجام آزمایش در خلاف جهت باد در کنار شعله بایستید. (تا به این ترتیب نسیم، دود حاصل از سوختن سیخها را از شما دور کند.) همچنین برای احتیاط یک ظرف آب همراه خود داشته باشید.
زمانی که هوا تاریک است شمع، کبریت و سیخهای آمادهی خود را به فضای باز در جایی برید که بتوانید به راحتی شمع را روشن کنید. مطمئن شوید که جریان هوا در آن محل مناسب است و در طول انجام آزمایش در خلاف جهت باد در کنار شعله بایستید. (تا به این ترتیب نسیم، دود حاصل از سوختن سیخها را از شما دور کند.) همچنین برای احتیاط یک ظرف آب همراه خود داشته باشید.
 از یک بزرگتر بخواهید شمع را روشن کند.
از یک بزرگتر بخواهید شمع را روشن کند.
 هنگامی که شمع به خوبی در حال سوختن است و در حالی که در خلاف جهت وزش شعله ایستادهاید، یکی از سیخهای آماده را بردارید و سر آغشته به مادهی شیمیایی آن را داخل شعله نگه دارید. دقت کنید که به هیچ وجه دود حاصل از سوختن سیخ را استنشاق نکنید. شعلهی سوختن این ماده چه رنگی است؟ رنگ آن چه تفاوتی با رنگ شعلهی شمع در حالت عادی دارد؟ برای دیدن رنگ شعله میتوانید شعلهی شمع را در حین سوختن سیخ نگاه کنید و یا میتوانید به جای آن زمانی که مادهی شیمیایی سر سیخ آتش میگیرد آن را از روی شمع دور کنید و سپس به شعلهی سر سیخ نگاه کنید
هنگامی که شمع به خوبی در حال سوختن است و در حالی که در خلاف جهت وزش شعله ایستادهاید، یکی از سیخهای آماده را بردارید و سر آغشته به مادهی شیمیایی آن را داخل شعله نگه دارید. دقت کنید که به هیچ وجه دود حاصل از سوختن سیخ را استنشاق نکنید. شعلهی سوختن این ماده چه رنگی است؟ رنگ آن چه تفاوتی با رنگ شعلهی شمع در حالت عادی دارد؟ برای دیدن رنگ شعله میتوانید شعلهی شمع را در حین سوختن سیخ نگاه کنید و یا میتوانید به جای آن زمانی که مادهی شیمیایی سر سیخ آتش میگیرد آن را از روی شمع دور کنید و سپس به شعلهی سر سیخ نگاه کنید
 ممکن است پس از چند لحظه باقی سیخ نیز آتش بگیرد. در این صورت به سرعت آن را داخل ظرف آب ببرید تا خاموش شود.
ممکن است پس از چند لحظه باقی سیخ نیز آتش بگیرد. در این صورت به سرعت آن را داخل ظرف آب ببرید تا خاموش شود.
 همین روند را در مورد پنج سیخ دیگر نیز انجام دهید. (برای تشخیص اینکه کدام مادهی شیمیایی را میسوزانید، دقت کنید که سر سیخهای آغشته به سدیم کلرید (نمک خوراکی) سفید و سر سیخهای آغشته به سولفات مس آبی هستند.) شعلهی سوختن سدیم کلرید چه رنگی است؟ مس سولفات با چه رنگی میسوزد؟
همین روند را در مورد پنج سیخ دیگر نیز انجام دهید. (برای تشخیص اینکه کدام مادهی شیمیایی را میسوزانید، دقت کنید که سر سیخهای آغشته به سدیم کلرید (نمک خوراکی) سفید و سر سیخهای آغشته به سولفات مس آبی هستند.) شعلهی سوختن سدیم کلرید چه رنگی است؟ مس سولفات با چه رنگی میسوزد؟
آزمایش تکمیلی:
 میتوانید در این فعالیت علمی فلزات دیگری را برای تولید رنگ شعلههای متفاوت بسوزانید. برای این کار همیشه تمام نکات ایمنی لازم برای کار با مواد شیمیایی مختلف و آتش زدن آنها را رعایت کنید. فلزات دیگر در هنگام سوختن چه رنگهایی ایجاد میکنند؟
میتوانید در این فعالیت علمی فلزات دیگری را برای تولید رنگ شعلههای متفاوت بسوزانید. برای این کار همیشه تمام نکات ایمنی لازم برای کار با مواد شیمیایی مختلف و آتش زدن آنها را رعایت کنید. فلزات دیگر در هنگام سوختن چه رنگهایی ایجاد میکنند؟
مشاهده و نتیجهگیری:
آیا سر سیخ آغشته به سدیم کلرید با رنگ شعلهی زرد-نارنجی و سر سیخ آغشته به سولفات مس با رنگ شعلهی سبز متمایل به آبی میسوزد؟
یک شعله به طور معمول با رنگ زرد-نارنجی و کمی رنگ آبی در قسمت پایین شعله میسوزد. در هنگام سوختن سر سیخ آغشته به سدیم کلرید باید مشاهده کنید که شعله به رنگ خالص زرد-نارنجی (بدون رنگ آبی در پایین شعله) درمیآید. دلیل آن است که فلز سدیم در هنگام سوختن نور شدید زرد-نارنجی از خود ساتع میکند. در هنگام سوختن سر سیخ آغشته به سولفات مس باید مشاهده کنید که شعله به رنگ آبی-سبز درمیآید. دلیل آن است که فلز مس در هنگام سوختن نور آبی-سبز از خود ساتع میکند.
اگر الکترونهای یک اتم انرژی از دست بدهند به سطوح انرژی پایینتر منتقل میشوند و انرژی از دست داده شده میتواند به شکل نور از اتم ساتع شود. اتمها یا عناصر مختلف دارای فواصل خاص بین سطوح انرژی خود هستند؛ به همین دلیل در حین سوختن با از دست دادن انرژی، نور با رنگهای متفاوتی تولید میکنند.
تمیز کردن:
بعد از تمام شدن فعالیت حتماً شعلهی شمع و سیخها را خاموش کنید. پس از خاموش کردن کامل شعلهی سیخها (با فرو بردن آنها در ظرف آب) میتوانید آنها را در سطل زباله بیندازید.
منبع:
Exploring the Chemistry of Fireworks
منابع مفيد:
Flame Tests
Flame Coloration by element
آتش رنگي
تراز انرژي
اتم
فلز
مس
سديم
بخش فيزيک فعاليتهاي علمي رشد
حقايقي دربارهي انفجار سديم
بخش شيمي فعاليتهاي علمي رشد