زنگ تفریح 219، تاریخچه، شرایط مربوطه، پتانسیل شیمیایی ترمودینامیکی
<<قسمت قبل
تاریخچه
گیبس در مقاله خود در سال 1873 به نام "روشی در توصیف هندسی خواص ترمودینامیکی مواد در سطوح" خلاصهای ابتدایی از قوانین معادلهی جدیدش را معرفی میکند که میتواند میل فرایندهای طبیعی مختلف را زمانی که اجسام یا سیستمها در تماس قرار میگیرند، پیش بینی کند یا تخمین بزند. با مطالعه واکنشهای مواد همگن در تماس با هم، مانند اجسام، که در اجزای قسمتی جامد، قسمتی مایع و قسمتی بخار موجود هستند و همچنین با استفاده از نمودار 3بعدی حجم – آنتروپی – انرژی درونی، گیبس میتوانست 3 حالت تعادل را مشخص کند، برای مثال "لزوما پایدار"، "خنثی" و "ناپایدار"، خواه تغیراتی ایجاد میشد یا نمیشد. در 1876، گیبس بر اساس این چهارچوب مفهوم پتانسیل شیمیایی را معرفی کرد تا بتوان واکنشهای شیمیایی و حالتهای اجسامی را که از نظر شیمیایی متفاوت هستند را محاسبه کرد. در صحبتهای او برای ارائهی نتایجش در 1873، گیبس میگوید:
اگر ما بخواهیم در یک معادله موقعیت لازم و کافی تعادل ترمودینامیکی را برای یک ماده در حالت مقدار متوسط فشار (P) و دما (T) ثابت توضیح دهیم، این معادله را میتوان نوشت:
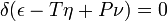
در اینجا ᵟ مربوط میشود به تغییر ایجاد شده توسط هر تغییر در حالت اجزای جسم، و (زمانی که بخشهای مختلف جسم دز حالتهای مختلف هستند) در نسبت زمانی که جسم میان حالتهای مختلف تقسیم شده است. موقعیت تعادل پایدار زمانی است که مقدار داخل پرانتز حداقل باشد.
در این توضیح، همانطور که توسط گیبس استفاده شده، ϵ مربوط به انرژی درونی جسم، ղ مربوط به آنتروپی جسم و v مربوط به حجم جسم است.
شرایط مربوطه
معنی دقیق عبارت پتانسیل شیمیایی به زمینهای که از آن استفاده میشود وابسته است.
· زمانیکه از سیستمهای ترمودینامیکی صحبت میکنیم، پتانسیل شیمیایی بیان کننده پتانسیل شیمیایی ترمودینامیکی است. در این زمینه، پتانسیل شیمیایی تغییر در تابع حالت خواص ترمودینامیکی نسبت به تغییر در تعداد مولکولها است. با توجه به شرایط آزمایشگاهی، تابع حالت خواص ترمودینامیکی این موارد میتواند باشد: انرژی درونی (internal energy)، آنتالپی (enthalpy)، انرژی گیبس (Gibbs energy) یا انرژی هلموتز (Helmholtz energy). این استفاده خاص بصورت گسترده توسط شیمیدانهای تجربی، فیزیکدانها و مهندسان شیمی استفاده میشود.
· شیمیدانها و فیزیکدانهای نظری معمولا از مفهوم پتانسیل شیمیایی در رابطه با پتانسیل شیمیایی الکترونی استفاده میکنند، که این مفهوم مربوط است به مشتق تابعی از تابع چگالی، که گاهی اوقات تابع انرژی نیز خوانده میشود، و در نظریهی چگالی تابعی نیز یافت میشود. این استفاده خاص از این مفهوم بصورت گسترده در شاخهی نظریهی ساختار الکترونی کاربرد دارد.
· فیزیکدانها گاهی اوقات از مفهوم پتانسیل شیمیایی در توضیح سیستمهای نسبیتی اجزای بنیادی استفاده میکنند.
پتانسیل شیمیایی ترمودینامیکی
پتانسیل شیمیایی یک سیستم ترمودینامیکی مقداری است که انرژی سیستم تغییر کند اگر یک ذره اضافی تولید شود، زمانی که آنتروپی و حجم ثابت نگاه داشته میشوند. اگر یک سیستم بیش از یک نوع ذره داشته باشد، پتانسیل شیمیایی جداگانهای برای هر جزء وجود دارد، که بعنوان تغییر در انرژی زمانی که تعداد ذرات یک گونه توسط دیگری افزایش مییابد، تعریف میشود. پتانسیل شیمیایی یک پارامتر بنیادی در علم ترمودینامیک است و با تعداد ذره توام است.
|
پتانسیل شیمایی زمانی که سیستمهای ذرات در حال واکنش را بررسی میکنیم به طور ویژه مهم است. سادهترین حالت دو جزئی را در نظر بگیرید، وقتی ذرهای از جزء 1 بتواند به ذرهای از جزء 2 تبدیل شود و بالعکس. یک مثال از چنین سیستمی، مخلوطی اشباع از آب مایع (جزء 1) و بخار آب (جزء 2) است. اگر یک سیستم در تعادل باشد، پتانسیل شیمیایی دو جزء باید با هم برابر باشند. از طرف دیگر، یک آزادسازی شبکهای از انرژی بصورت گرما اتفاق میافتد (قانون دوم ترمودینامیک) زمانی که اجزای با پتانسیل شیمیایی بالاتر به اجزای دیگر تبدیل میشوند و یک جذب شبکهای انرژی (باز هم بصورت گرما) برای تبدیل برعکس اتفاق میافتد. در واکنشهای شیمیایی، شرایط تعادل عموما پیچیدهتر هستند زیرا بیش از دو جزء درگیر هستند. در این حالت، رابطهی میان پتانسیلهای شیمیایی در تعادل توسط قانون فعالیت جرمی (law of mass action) بیان میشود.
|
 |
به این دلیل که پتانسیل شیمیایی یک مقدار ترمودینامیکی است، مستقلانه توسط رفتار میکروسکوپی سیستم تعریف میشود، برای مثال خواص ذرات جزء تشکیل دهنده. البته، بعضی سیستمها شامل متغیرهایی میشوند که هم ارز هستند با پتانسیل شیمیایی. در گازهای فرمی (Fermi gases) و مایعات فرمی (Fermi liquids)، پتانسیل شیمیایی در دمای صفر هم ارز است با انرژی فرمی (Fermi energy). در سیستمهای الکترونی، پتانسیل شیمیایی به پتانسیل الکترونی موثر وابسته است.
یک روش برای فهم پتانسیل شیمیایی در نظر گرفتن یک مول از متان و 2 مول از اکسیژن است. اگر یک شعله نزدیک این مخلوط شود، واکنش زیر روی میدهد:
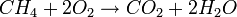
و انرژی (گرما) آزاد میشود. این انرژی از تفاوت در پتانسیل شیمیایی میان CH4 و O2 در یک طرف (پتانسیل شیمیایی بالاتر) و CO2 و H2O در طرف دیگر (پتانسیل شیمیایی کمتر) حاصل میشود. تمام انرژی که آزاد میشود توسط این معادله بدست میآید:
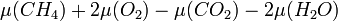
مثالهای مشابه را میتوان در باتریها زمانی که انرژی شیمیایی به انرژی الکتریکی تبدیل میشود یافت.
قسمت بعد>>