زنگ تفریح 189، قرن 19 و 20، نظریهی مولکولی، شاخههای جدید شیمی
VI. قرن 19 و 20
با شروع قرن 19 دقت در شیمی تجزیه به قدری پیشرفت کرده بود که شیمیدانان میتوانستند نشان دهند که ترکیبات سادهای که با آنها کار کرده بودند شامل مقادیر ثابت و غیرفرار از عناصر سازندهشان هستند. در برخی موارد، البته بیش از یک ترکیب میتوانست از عناصر مشابه تشکیل شود. در همین زمان شیمیدان و فیزیکدان فرانسوی، ژوزف گیلوساک نشان داد که نسبت حجمی گازهایی که در واکنش با هم هستند اعدادی صحیح و کوچک هستند (که این موضوع برهمکنش ذرات گسسته که بعدها نشان داده شد اتمها هستند را دلالت کرد). یک قدم مهم در توضیح این مسایل، نظریهی اتمی دانشمند انگلیسی، جان دالتون، در سال 1803 بود.

دالتون فرض کرد که وقتی دو عنصر با هم ترکیب میشوند،ترکیب حاصل شامل یک اتم از هر کدام از آن عناصر است. در این سیستم، آب میتواند فرمولی به شکل HO داشته باشد. او به طور قراردادی وزن اتمی 1 را به هیدروژن نسبت داد و سپس توانست وزن اتمی نسبی اکسیژن را محاسبه کند. با استفاده از این قانون در مورد ترکیبات دیگر، او وزن اتمی عناصر دیگر را نیز محاسبه کرد و جدولی بر اساس وزن نسبی عناصر شناخته شده تا آن زمان تهیه کرد. نظریهی او اشکالات زیادی داشت، ولی ایدهاش درست بود و یک اندازهی دقیق توسط این روش میتوانست بعدها به وزن هر اتم نسبت داده شود.
A. نظریهی مولکولی
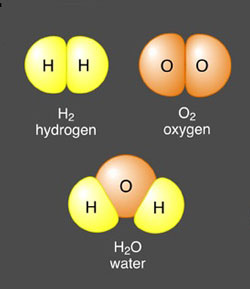
ضعف بزرگ نظریهی دالتون این بود که او قانون نسبتهای اضعافی را در نظر نگرفته بود و هیچ تفاوتی میان مولکول و اتم قائل نشده بود. بنابراین، او نمیتوانست میان فرمولهای احتمالی HO و H2O2 برای آب تفاوتی قائل شود همانطور که نمیتوانست توضیح دهد که چرا چگالی بخار آب، در حالی که فرض کرده بود دارای فرمول HO است از چگالی گاز اکسیژن که برای آن فرمول O را فرض کرده بود کمتر است. پاسخ این مشکلات در سال 1811 توسط فیزیکدان ایتالیایی، آمدئو آووگادرو پیدا شد. او حدس زد تعداد ذرات در حجمهای مساوی از گازها در فشار و دمای برابر، با هم برابر است و فهمید که میان مولکولها و اتمها تفاوت وجود دارد. زمانی که اکسیژن با هیدروژن با اکسیژن ترکیب میشود یک اکسیژن دو اتمی (در اصطلاح ما یک مولکول) نصف میشود و سپس هر اتم اکسیژن با دو اتم هیدروژن ترکیب میشود و فرمول مولکولی H2O را برای آب میدهد و فرمولهای O2 و H2 برای مولکولهای اکسیژن و هیدروژن هستند.
متاسفانه، از نظریات آووگادرو نزدیک به 50 سال چشمپوشی شد و در طول این زمان اغتشاشی عظیم در میان شیمیدانان در محاسباتشان بوجود آمده بود. وضع به همین شکل بود تا سال 1866 که شیمیدان ایتالیایی، استانیسلائو کنیزارو نظریات آووگادرو را دوباره معرفی کرد. در این زمان شیمیدانان دریافته بودند که در نظر گرفتن وزن اتمی 16 برای اکسیژن به عنوان استانداردی برای تعیین وزن اتمی بقیه عناصر بسیار مناسبتر از استفاده از وزن اتمی هیدروژن است که توسط دالتون استفاده شده بود.سپس به طور جهانی وزن مولکولی 32 برای اکسیژن مورد استفاده قرار گرفت و با مقیاس گرم بیان شد که وزن یک مولکول گرم اکسیژن یا به طور سادهتر یک وزن مول اکسیژن نام گرفت. محاسبات شیمیایی استاندارد شد و فرمولهای ثابت نوشته شدند.
مشکل قدیمی طبیعت میل ترکیبی ماده شیمیایی، حل نشده باقی مانده بود. زمانی اینگونه به نظر میرسید که پاسخ ممکن است در شاخهی تازه کشف شدهی الکتروشیمی موجود باشد. کشف پیل ولتایی در سال 1800، اولین باتری واقعی، به شیمیدانان ابزاری جدید داد که منجر به کشف فلزاتی مانند سدیم و پتاسیم شد. برای برزیلیوس اینگونه به نظر میرسید که نیروهای الکترواستاتیکی مثبت و منفی است که احتمالا عناصر را در کنار هم نگاه میدارد، در ابتدا نظریهی او به صورت عمومی مورد قبول واقع شد. به تدریج شیمیدانان ترکیبات و واکنشهای جدید بیشتری را تولید و مطالعه کردند که به نظر میرسید که در آنها نیروهای الکتریکی دخیل نیستند (ترکیبات ناقطبی). لذا مشکل میل ترکیبی برای مدتی کنار گذاشته شد.
B. شاخههای جدید شیمی
برجستهترین پیشرفتها در در شیمی در قرن 19 در شاخهی شیمی آلی بود. نظریهی ساختاری، که تصویری واقعی از چگونگی قرار گرفتن اتمها در کنار هم عرضه میکرد، یصورت غیر ریاضی بود ولی منطقی از درون خودش داشت. این نظریه پیشبینی و تولید ترکیبات جدید بسیاری را ممکن ساخت که شامل تعداد زیادی رنگینه، دارو و مواد منفجرهی مهم میشد که منجر به رشد صنایع شیمیایی عظیم به خصوص در آلمان شد.
در همین زمان شاخههای دیگر شیمی ظهور کردند. سپس با تاثیر پذیری از پیشرفتهای فیزیکی بعضی شیمیدانان به سمت استفاده از روشهای ریاضی در علمشان روی آوردند. مطالعات سرعت واکنشهای شیمیایی منجر به گسترش نظریات سینتیکی شد که هم ارزش صنعتی و هم ارزش علمی خالص داشت. فهم این که گرما به دلیل حرکت تعادلی اتمی به وجود میآید، یک پدیدهی سینتیکی، منجر به رد نظریهای شد که گرما را به صورت یک مادهی مشخص میدانست (که کالریک خوانده میشد) و آغازگر ترمودینامیک شیمیایی بود. ادامهی مطالعات الکتروشیمیایی، شیمیدان سوئدی، سوانته آگوست آرنیوس را به سمت پذیرفتن تفکیک نمکها در محلول و تشکیل یونهایی که بار الکتریکی حمل میکنند هدایت کرد. مطالعات نشر و جذب طیفهای عناصر و تزکیبات هم برای شیمیدانها و هم برای فیزیکدانها اهمیت یافت. علاوه بر این، تحقیقات ابتدایی در کلویید و نورشیمی آغاز شد. در اواخر قرن 19 این نوع مطالعات در شاخهای که به عنوان شیمیفیزیک شناخته میشود با هم آمیختند.
شیمی معدنی نیز نیاز به سازماندهی داشت. تعداد عناصر جدیدی که کشف میشدند در حال رشد بود، ولی هیچ روش منطقی وجود نداشت که بتواند قانونی برای واکنشهای عناصر تعریف کند. رشد مستقل قانون تناوبی توسط شیمیدان روسی، دیمیتری ایوانوویچ مندلیف در سال 1869 و شیمیدان آلمانی ژولیوس لوتار میر (Julius Lothar Meyer) در سال 1870، این اختلال را رفع کرد و مشخص کرد که عناصر جدید در کجا یافت خواهند شد و خواصشان چه خواهد بود.
در پایان قرن 19، به نظر میرسید که شیمی نیز مانند فیزیک به مرحلهای رسیده است که شاخههای برجستهی دیگری برای رشد باقی نمانده است. این دیدگاه با کشف پرتوزایی به طور کامل تغییر کرد. روشهای شیمیایی در جداسازی عناصر جدید مانند رادیوم، جداسازی طبقهی جدیدی از مواد که به عنوان ایزوتوپها شناخته میشدند و در سنتز و جداسازی عناصر دارای عدد اتمی بیشتر از عدد اتمی اورانیوم (transuranium elements) مورد استفاده قرار گرفتند. تصویر جدیدی که از ساختار واقعی اتمها توسط فیزیکدانها بدست آمده بود مشکل قدیمی میل ترکیبی شیمیایی را حل کرد و رابطهی میان ترکیبات قطبی و ناقطبی را توضیح داد.
پیشرفت بزرگ دیگر برای شیمی در قرن 20 ظهور زیستشیمی بود. این شاخه با آنالیز سادهی سیالات بدن شروع شد، سپس روشها به سرعت برای تعیین طبیعت و کارایی اجزاء سازندهی اکثر سلولهای پیچیده گسترش یافتند. در اواسط قرن، زیستشیمیدانها کد ژنتیکی را رمزگشایی کردند و عملکرد ژن، بنیان تمام زندگیها، را توضیح دادند. این شاخه به صورت بسیار گسترده رشد کرد که مطالعهی آن تبدیل به یک علم جدید به نام زیستشناسی مولکولی شد.
