مسابقه 257
یکی از سوالات المپیاد شیمی 2012 آمریکا که مربوط به آرایش الکترونی است که مطلبی بسیار مهم در شیمی و المپیاد است. امیدواریم همه شما دوستان عزیز با مطالعه توضیحات و اطلاعات خودتان جواب درست را در قسمت نظرات برای ما بفرستید.
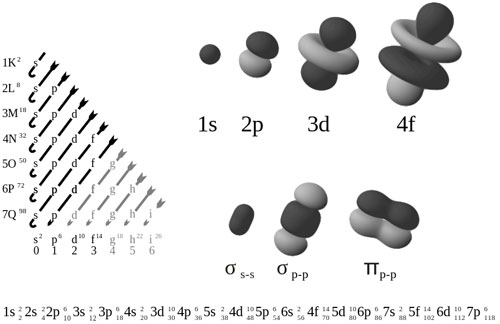
در فیزیک اتمی و شیمی کوانتوم، آرایش الکترون به توزیع الکترونهای یک اتم یا مولکول (یا ساختار فیزیکی دیگری) در اوربیتالهای آن اتم یا مولکول گویند.برای مثال آرایش الکترونی اتم نئون (Ne) به صورت 1s2,2s2 2p6 میباشد. آرایش الکترونی نشان میدهد که هر الکترون به صورت مستقل در یک اوربیتال یا یک میدان متوسطی از تمامی اوربیتالها در حرکتند.از نظر ریاضی نیز آرایش الکترونی توسط دستگاه دترمینان یا تابع حالت کنفیگوراسیون (configuration state functions) بیان میشود. بنابر قوانین حاکم بر مکانیک کوانتوم در سیستمهای تک الکترونی بنابر کنفیگوراسیون خاصی که الکترون به خود میگیرد دارای انرژی خاصی میباشد که میتواند بنابر شرایط خود از یک آرایش و اوربیتال خاص با انتشار یا جذب مقدار معینی انرژی به صورت فوتون (شعاع نوری) به یک آرایش یا اوربیتال دیگر برود.
 |
برای اتمها یا مولکولهایی با بیش از یک الکترون حرکت الکترونها به یکدیگر وابسته است و همانطور که در شکل دیده میشود نمیتوان انرژی را تنها به یک آرایش الکترون خاصی مربوط ساخت. آرایش الکترونی مولکولهای چند اتمی حتی بدون جذب یا انتشار فوتون از میان جفتهای ارتعاشی الکترونیکی (vibronic couplings) میتواند تغییر کند. دانش آرایش الکترونی در اتمهای مختلف بسیار در یادگیری ساختار و دلیل کنارهم قرار گرفتن عناصر در جدول تناوبی کارآمد است. این دانش در ضمن برای پیوندهای شیمیایی که اتمها را به هم وصل میکنند. مخصوصا در شناخت بهتر خواص عجیبی که در لیزرها و نیمهرساناها دیده میشود.
لایهها و زیرلایهها
آرایش الکترونی برای اولین بار به طور مؤثر توسط مدل اتمی بور (bohr model) بهتر درک شد به طوری که هنوز هم استفاده از اصطلاحات لایه در زیرلایه برای درک مکانیک کوانتوم
و طبیعت عناصر رایج است.
لایههای الکترون یک فضای قابل دسترس است که الکترون تنها مجاز است این فضا را اشغال کند که به آن عدد کوانتومی اصلی که با نماد n نمایش داده میشود، شناخته میشود. در خود لایهها نیز الکترونها در درون اوربیتالهای خود قرار میگیرند برای مثال در لایه اول حداکثر 2 الکترون در یک اوربیتال (s) و برای لایهی دوم حداکثر 8 الکترون در دو اوربیتال (s,p) و در لایهی سوم حداکثر 18 الکترون در سه اوربیتال (s,p,d) قرار دارند. هر اوربیتال نیز از زیرلایههایی دستهبندی شدهاند که در هر کدام 2 الکترون قرار میگیرند. فاکتوری که به این دو الکترون اجازه میدهد تا بتوانند کنار هم قرار گیرند اسپین گویند که هر دو الکتروندر یک زیرلایه بایستی دارای اسپین مخالف باشند. یکی با اسپین 2/1 که با یک فلش به سمت بالا نمایش داده میشود و دیگری با اسپین 2/1- که با فلش به سمت پایین نشان داده میشود.
زیرلایهها که معمولا با عدد کوانتومی اوربیتالی شناخته میشوند و با نماد l نشان داده میشوند دارای ارزشهای 3،2،1،0 میباشند که به ترتیب نمایانگر اوربیتالهای f,d,p,s هستند.
سوال این مسابقه نیز یکی از سوالات المپیاد شیمی 2012 آمریکا است که در مورد همین مطلب یعنی آرایش الکترونی میباشد. که با کمی دقت به راحتی حل میشود.
فاز گازی اتمی با آرایش الکترونی
1s2,2s2 2p6,3s2 3p6,4s2 3d6
3الکترون خود را از دست میدهد. کدام یک از جوابها بیانگر آرایش الکترونی گاز یونیزه شدهاست؟
1)1s2,2s2 2p6,3s2 3p6 3d5
2)1s2,2s2 2p6,3s2 3p6,4s1 3d4
3)1s2,2s2 2p6,3s2 3p6,4s2 3d3
4)1s2,2s2 2p6,3s2 3p5,4s1 3d5