زنگ تفریح 218، مقدمه و دید کلی
مقدمه
در علم ترمودینامیک، پتانسیل شیمیایی که با µ نشانه گزاری میشود، مقدار پتانسیلی است که یک ماده باید تولید کند برای اینکه یک سیستم را تغییر دهد. در وسیعترین معانی، پتانسیل شیمیایی مشابه پتانسیل الکتریکی یا پتانسیل گرانشی است که از همان نظریهی میدانهای نیرو به عنوان حرکت اشیا استفاده میکند، که این میدانها میتوانند بارهای الکتریکی، اجرام یا در حالتی مواد شیمیایی باشند. پتانسیل شیمیایی اولین بار توسط مهندس آمریکایی، شیمیدان و ریاضی فیزیک دان، جوسایا ویلارد گیبس (Josiah Willard Gibbs) توصیف شد. او پتانسیل شیمیایی را مانند زیر تعریف کرد:
اگر به هر جرم همگنی در حالت تنش ایستایی (hydrostatic stress) فرض کنیم مقداری بینهایت کوچک از مادهای اضافه شود، جرم همگن میماند و آنتروپی و حجم آن بدون تغییر باقی میماند، افزایش انرژی جرم که توسط ماده اضافه شده پخش میشود پتانسیل شیمیایی آن ماده در جرم مطرح شده است.
|
گیبش بعدها اشاره کرد که همچنین برای اهداف این تعریف، هر عنصر شیمیایی یا مخلوطی از عناصر با ترکیب درصد معین میتواند به عنوان یک ماده در نظر گرفته شود، خواه بتواند، خواه نتواند به عنوان یک جسم همگن وجود داشته باشد. این آزادی در انتخاب حدود سیستم باعث میشود که پتانسیل شیمیایی در محدودهی گستردهای از سیستمها استفاده شود. این مفهوم میتواند در علم ترمودینامیک و فیزیک برای هر سیستم در حال تغییر استفاده شود. پتانسیل شیمیایی همچنین معادل است با مقدار پارشیال مولار انرژی گیبس (partial molar gibbs energy). در اصل ابتدا رابطهی مقدار پارشیال مولار انرژی گیبس کشف شد اما به دلیل اهمیت و کاربردهای زیاد آن در سیستمهای تعادلی ترمودینامیکی نام پتانسیل شیمیایی را روی آن گزاشتند. پتانسیل شیمیایی در واحد انرژی/ذره (energy/particle) یا معادل آن انرژی/مول (energy/mole) اندازهگیری میشود.
|
 |
در شیمی، پتانسیل شیمیایی معمولا منحصر میشود به مواردی که شامل تغییر شیمیایی میشود یا تغییر فیزیکی که بر روی مسیر واکنش شیمیایی تاثیر دارد (فاز، غلظت و ...) و یا مربوط میشود به خاصیتی مانند چگالی الکترونی. در علم فیزیکی ایستایی مدرن، پتانسیل شیمیایی، توسط دما تقسیم میشود و ضرب کنندهی لاگرانژ (Lagrange multiplier) برای متوسط محدودیت ذرات در حداکثر سازی آنتروپی است. این یک تغریف علمی جامع و انتزاعی هست، دقیقا مانند دما که بصورت ضرب کنندهی لاگرانژ برای محدودیت متوسط انرژی تعریف میشود.
در الکتروشیمی و بعضی شاخههای مرتبط، کلمه پتانسیل شیمیایی برای مفهوم تغییرات اساسی (ولی مرتبط) استفاده میشود که بصورت پتانسیل شیمیایی درونی (internal chemical potential) تعریف میشود.
در فیزیک نیمه رسانا، پتانسیل شیمیایی یک سیستم از الکترونها به عنوان تراز فرمی (Fermi level).
دید کلی
ذرات علاقه دارند که از پتانسیل شیمیایی بیشتر به پتانسیل شیمیایی کمتر منتقل شوند. به این روش، پتانسیل شیمیایی یک تعمیم از پتانسیلها در فیزیک هست مانند پتانسیل گرانشی. وقتی یک توپ به سمت پایین یک تپه میغلتد، از پتانسیل گرانشی بالاتر (ارتفاع بالاتر) به سمت پتانسیل گرانشی پایینتر (ارتفاع پایینتر) در حرکت است. به همین شیوه، همزمان با حرکت، واکنش، حل شدن و ... مولکولها، آنها همواره بصورت طبیعی از پتانسیل شیمیایی بالاتر به مقدار پایینتر میروند.
|
یک مثال ساده یک سیستم رقیق از مولکولهای است که در یک محیط همگن نفوذ میکنند (انیمیشن سمت چپ). در این سیستم، مولکولها همواره مایل هستند که از مناطق با غلظت بالا به غلظت پایین حرکت کنند، تا زمانی که غلظت در همه جا یکسان شود. توضیح میکروسکوپی برای این اتفاق بر پایه نظریهی سینتیکی و حرکت اتفاقی مولکولها است. البته، راحتتر است که این فرایند را توسط پتانسیل شیمیایی توضیح دهیم: یک مولکول در یک منطقه با غلظت بالاتر دارای پتانسیل شیمیایی بالاتری هست و در غلظت پایینتر دارای پتانسیل شیمیایی پایینتری است. مانند همیشه، مولکولها از پتانسیل شیمیایی بالاتر به پتانسیل شیمیایی پایینتر حرکت میکنند.
|
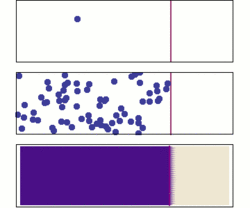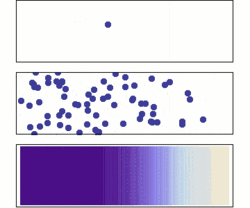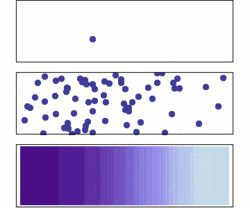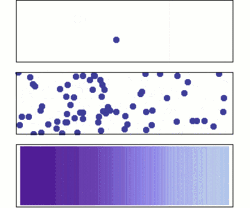
نفوذ از دو دیدگاه میکروسکوپی و ماکروسکوپی. در ابتدا، مولکولهای حل شده در سمت چپ سد (خط ارغوانی) هستند و در سمت راست چیزی نیست. سد برداشته میشود، و محلول پخش میشود تا تمام محفظه را پر کند. بالا: یک مولکول تک به صورت اتفاقی به اطراف حرکت میکند. وسط: با مولکولهای بیشتر، محلول تمام محفظه را تقریبا بصورت یکنواخت پر میکند. زیر: با مقدار بسیار زیادی از مولکولهای حل شده، تمام شواهد اتفاقی بودن از بین میرود: به نظر میرسد محلول به آرامی و به صورت منظم از مناطق غلیظ به مناطق با غلظت کمتر حرکت میکند، مطابق با قانون نفوذ فیک.
|
یک مثال دیگر یک لیوان آب همراه با قطعات یخ در آن است. بالای 0oC، یک مولکول H2O به عنوان یک قسمت از مایع دارای پتانسیل شیمیایی پایینتری هست نسبت به قسمتی از قطعه یخ. یخ برای اینکه مولکولهای H2O پتانسیل شیمیایی خود را پایین بیاورند ذوب میشوند. پایین 0oC، یخ دارای پتانسیل شیمیایی کمتری هست، لذا قطعات یخ رشد میکنند. دقیقا در 0oC، پتانسیل شیمایی برای آب و یخ مشابه هست؛ قطعات یخ نه رشد میکنند و نه کاهش مییابند، و سیستم در حال تعادل است.میتوان به زبانی سادهتر گفت در یک سیستم چند فازی تا زمانی ماده میان فازهای تبادل میشود که انرژی پتانسیل ماده در دو فاز یکسان شود و از آن به بعد تعادل رخ میدهد. لازم به ذکر هست که تعادلات همواره در فشار و دمای یکسان صورت میگیرند.
در الکتروشیمی، یونها همواره تمایل ندارند از پتانسیل شیمی بالاتر به پایینتر حرکت کنند، ولی همواره از پتانسیل الکتروشیمی بالاتر به پایینتر حرکت میکنند. پتانسیل الکتروشیمیایی کاملا تمام تاثیرات بر روی حرکت یون را مشخص میکند، در حالیکه پتانسیل شیمیایی شامل همه چیز میشود به جز نیروی الکتریکی.
قسمت بعد>>