مدلي براي بهينهسازي الکتروليت استفاده شده در ليتيوم باتريهاي هوا-ليتيوم ارائه شده است.

باتريهاي هوا-فلز به دليل اينکه وزن سبک، ماندگاري طولاني و توان بالايي دارند، مورد استفاده هستند. اما يکي از مشکلاتي که باتريهاي هوا-ليتيوم دارند، تجمع مواد جامد بر روي کاتد کربني است. گروهي از محققان از چندين مرکز پژوهشي، نشان دادهاند که الکتروليتي که با تعداد آنيونهاي زياد در يک حلال غيرآبي با تعداد ذرههاي کم ساخته شده باشد ميتواند ظرفيت باتريهاي هوا-ليتيوم را افزايش دهد. نتايج کار اين گروه پژوهشي در مقالههاي آکادمي ملي علوم منتشر شده است.
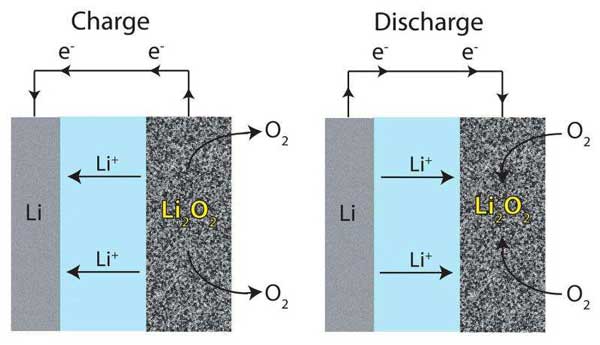
در باتريهاي هوا-ليتيوم غيرآبي، فرآوردهي واکنش شيميايي ليتيوم پراکسيد است. ليتيوم پراکسيد در الکتروليتهاي آلي نامحلول است به همين علت در سطح کاتد رسوب ميکند و به تدريج کاتد را از شرکت در واکنش باز ميدارد. به اين ترتيب ظرفيت باتري کاهش مييابد.
يکي از روشهايي که ميتواند اين شکل را حل کند، مناسبسازي الکتروليت براي حل کردن فرآوردههاي جانبي در خود است. برک (Burke) و همکارانش با اجراي آزمايشهاي مختلف کمي و کيفي، چگونگي بالا بردن حلّاليت الکتروليت را نسبت به ليتيوم پراکسيد به منظور افزايش ظرفيت باتري بررسي کردند. اين امر باعث ميشد تعداد يونهاي ليتيوم مثبت و يونهاي اکسيژن منفي در محلول زياد شده و ظرفيت سلول بالا برود.
برک و همکارانش تصميم گرفتند براي طراحي محلول الکتروليتي خود، از دو نمک مختلف با بار منفي متفاوت استفاده کنند. آنها نمکهاي NO3-و TSFI- را انتخاب کردند تا دريابند چگونه نمک يا حلال ذرات باردار با بار مثبت را در محلول جذب ميکنند. قدم اول اين بود که محققان تأثير آنيونها را بر تخليه ي باتري مشاهده کنند. آنها باتريهاي هوا-ليتيوم مختلفي را با غلظتهاي متفاوت نمکها بررسي کردند. نتيجهي کار نشان ميداد که ظرفيت باتري با افزايش غلظت يونهاي منفي NO3- تا 4 برابر بيشتر ميشد. يعني انتخاب آنيون نقش مهمي در روند چرخهي سلول الکتريکي ايفا ميکند.
برک و همکارانش همچنين ويژگيهاي ترموديناميکي محلول را بررسي کردند تا بتوانند به مدل کمّي صحيحي برسند که نشان دهندهي اثر تعداد آنيونها بر ظرفيت باتري باشد. آنها ابتدا کار خود را با استفاده از مدل فرومغناطيس (مدل آيزينگ) آغاز کردند تا حلالپوشي يون مثبت ليتيوم را تعريف کنند. اين مدل براي مطالعهي برهم کنشهاي مختلف ميان ذرههاي همسايه استفاده ميشود. سپس آنها با استفاده از تقريب و ميانگين، مدل مذکور را سادهسازي کردند. محققان به اين نتيجه رسيدند که ميزان حلّاليت يونهاي مثبت ليتيوم تابعي از تعداد آنيونها در حلال است.
برک و همکارانش با استفاده از اين مدل يک طرح کانتوري ايجاد کردند که ارتباط کلي ميان يونهاي ليتيوم و آنيونها را برقرار ميکرد. به طور کلي بايد گفت که آنيونهايي که تعدادشان بيشتر از حلال پايدار يون مثبت ليتيوم است، به ليتيوم پراکسيد اجازهي رسوب را نميدهند و اين باعث ميشود که ظرفيت باتري بالا رود. اين راه حل يکي از محدوديتهاي باتريهاي هوا-ليتيوم را از ميان برداشته است. علاوه بر اين ممکن است اين تغيير قابل اعمال بر ساير باتريهاي گاز-فلز نيز باشد.
سازوکاري براي باتريهاي هوا-سديم هيدروژندار:
فعالان صنعت خودروسازي به اخبار دنياي باتري علاقهمندند. آنها در انتظار ظهور باتريهايي هستند که بتوانند خودروهاي برقي را مانند بنزين در مسافتهاي نسبتاً طولاني همراهي کنند. هم اکنون باتريهايي که در خوردوهاي برقي استفاده ميشوند، از نوع ليتيومي هستند. البته محققان به طور کلي روي باتريهاي هوا-ليتيوم تمرکز کرده اند. زيرا اين باتريها از هوا به عنوان کاتد استفاده ميکنند و نيازي به حمل کاتد ندارند. همچنين چگالي انرژي اين باتريها مشابه چگالي انرژي بنزين است.

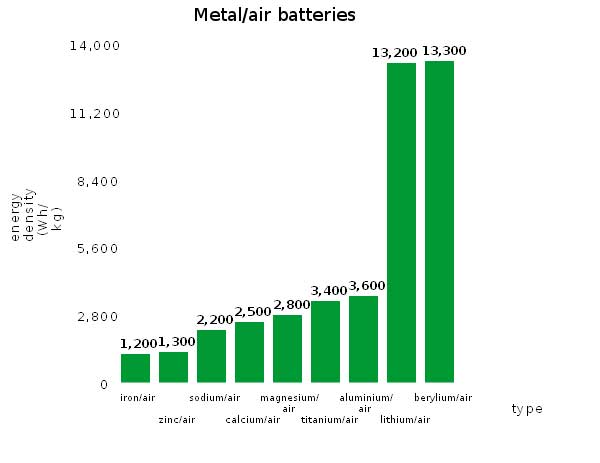
به تازگي دانشمندان در حال بررسي باتريهاي هوا-سديم هستند. زيرا با وجودي که چگالي انرژي کمتري نسبت به باتريهاي هوا-ليتيوم دارند، اما از بسياري جهتها برتريهايي دارند. باتريهاي هوا-سديم برخي مشکلات فني باتريهاي هوا-ليتيوم را ندارند و به همين دليل طول عمرشان بيشتر است. گروهي از پژوهشگران دانشگاه واترلو، براي روشن شدن تفاوت ميان باتريهاي هوا-سديم و هوا-ليتيوم نقش کاتاليزگرهاي انتقال فاز را در سازوکارهاي واکنش در باتري هوا-سديم کشف کردند. تحقيق آنها به تازگي در ژورنال نيچر شيمي (Nature Chemistry) منتشر شده است.
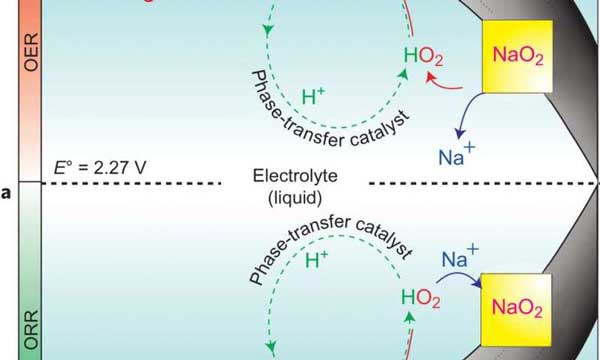
در باتريهاي سديمي، سديم آند است و کربن متخلخل که اکسيژن مولکولي را به دام مياندازد، کاتد است. باتري با گذراندن دو مرحله ي شارژ و تخليه ي شارژ کار ميکند. وقتي باتري تخليه شده است (يعني هيچ پتانسيلي به سيستم اضافه نشده است) سديم اکسيده شده و يون سديم مثبت را ايجاد ميکند. اين يون مثبت در محلول الکتروليت حرکت ميکند و به الکتروني ميرسد که از اکسيژن به دام افتاده توسط کاتد ايجاد شده است. واکنش اين دو يون با هم NaO2 را توليد ميکند. اين فرآيند برگشتپذير است و يونها ميتوانند دوباره توليد شوند.
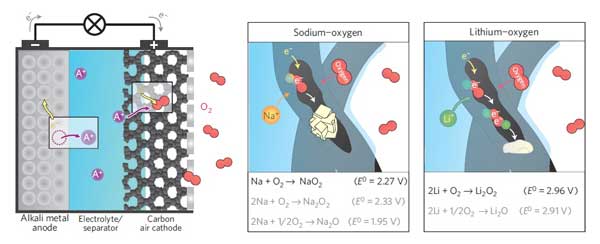
محققان دانشگاه واترلو با علم به اين که کريستالهاي NaO2 روي کاتد ايجاد ميشوند، نشان دادند که اين فرآيند منحصراً در حضور يک پروتون انتقال فاز به عنوان کاتاليزگر اتفاق ميافتد. شکلگيري بلورهاي NaO2 يک بار در حضور سديم آبدار که آب به عنوان منبع پروتن استفاده ميشود و يک بار با استفاده از سديم بدون آب بررسي شد. نتايج نشان ميدادند که با افزودن مقداري آب به الکتروليت، ظرفيت تخليهي شارژ باتري تا حد زيادي بالا ميرود. در صورت افزايش مقدار آب تا 100 ppm در الکتروليت، اين اثر به طور شديدتري مشاهده ميشد. اما در مقادير آب بالاتر از 100 ppm اثر مذکور کاهش مييافت.
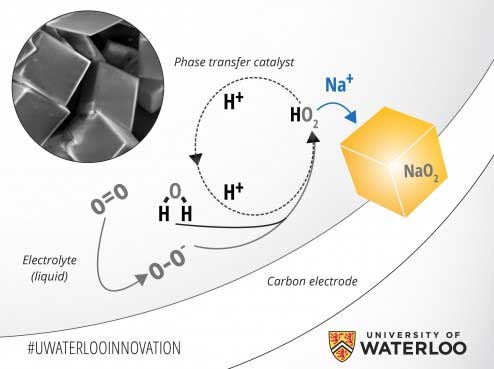
اين مطالعه نشان ميدهد که حرکت اکسيژن در محيط بدون آب تقريباً صفر بود. اما پس از افزودن آب به الکتروليت، تحرک اکسيژن مقداري ثابت بود. بنابراين وجود آب براي حرکت اکسيژن در هنگام شارژ باتري ضروري است. پس از تخليه ي شارژ باتري، اکسيژن در الکتروليت با آب واکنش ميدهد و فرآوردههاي HO2 و OH- توليد ميشوند. HO2 با يون سديم مثبت واکنش ميدهد و هستهي NaO2 را توليد ميکند و باعث تشکيل کريستالهاي H+ ميشود . اين يونها دوباره با يونهاي اکسيژن منفي واکنش ميدهند و آب توليد ميکنند. اين چرخه به طور مداوم ادامه دارد.
پژوهشگران واکنش بازگشت، يعني شارژ باتري را هم بررسي کردند تا مطمئن شوند که يون هيدروژن به عنوان يک کاتاليزگر عمل ميکند. در اين مرحله يونهاي H+ بايد با کريستالهاي NaO2 واکنش دهند تا HO2 را توليد کنند. سپس HO2 يونهاي منفي اکسيژن را در سطح کاتد ايجاد ميکنند. بررسيها نشان ميدهند که عليرغم اين که اين واکنش براي شروع به اعمال ولتاژ نسبتاً بالايي نياز دارد، اما در حضور آب به سادگي واکنش آغاز شده است. همچنين محققان دريافتند که معادل چنين واکنشي نميتواند براي باتريهاي هوا-ليتيوم رخ دهد. زيرا جهتهاي واکنشهاي اوليه و بازگشتي، مسيرهاي متفاوتي را دنبال ميکنند
در ادامه ي پژوهشها، قرار است حضور HO2 در محلولهاي الکتروليت آلي بررسي شوند. همچنين دانشمندان تلاش ميکنند روشي بيابند که باعث شود کريستالهاي NaO2 در محلي غير از سطح کاتد ايجاد شوند. به احتمال زياد با پيشرفتهاي بعدي سلولهاي الکتريکي هوا-سديم اين ايرادها نيز رفع خواهند شد.
منبع:
TechXplore.com
منابع مفيد:
باتري ليتيم هوا-ويکيپديا
مشکلات باتري ايتيم-هوا: science watch
خبرنامه دانشگاه واترلو-کانادا
Sodium-air battery
Volkswagen new batteries
باتريهاي سريع
الگوريتمي براي بالا بردن سرعت شارژ باتري
باتري دوربين ديجيتال
شارژ باتري خودروهاي خورشيدي در حين حرکت
باتري خودرو
الکتروشيمي
آند-کاتد
الکتروليز
سلولهاي خورشيدي چگونه کار ميکنند؟
بازدهي سلولهاي خورشيدي