لینوس پائولینگ (Linus Pauling) در سال 1948 بیان کرد که آنزیم های مقید به حالت های گذار، قوی تر از آنهایی کار می کنند که به سوبستراهای خود مقید هستند و 10 سال بعد، دانیل کوشلند (Daniel Koshland) با الگوی القایی پیشنهاد داد که وقتی سوبسترا به یک آنزیم نزدیک شده و به آن بپیوندد، تغییری در آرایش فضایی انزیم ها ایجاد می شود. اما نشان دادن این ایده ها در کاتالیزور پروتئین، به خاطر حجم وسیع و پیچیدگی آنها دشوار است.
اکنون؛ دانشمندانی از دانشگاه تیانجین (Tianjin University) در چین، و دانشگاه زوریخ (University of Zurich) در سوئیس و دانشگاه نورث وسترن (Northwestern University) آمریکا، آنالوگی ساده برای نشان دادن این نکته های کلیدی در تجزیه زیستی ساخته اند. واکنشی که مدلی مصنوعی از یک کاتالیزور زیستی را با سادگی در تجسم و درک، برای دانشجوریان بیوشیمی فراهم می کند و با تصویری کلاسیک از اصول تجزیه آنزیم، می تواند رویکردهای نوینی به سوی کاتالیزورهای بیومتریک باز کند.
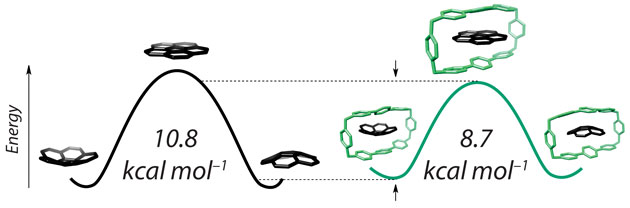
این گروه، سیکلوفان مستطیل شکل را به عنوان جایگاه فعال بکار برد و هیدروکربن آروماتیک چند حلقه ای کورانولن جانشین سوبسترا شد. کورانولن بگونه ای در حفره جا می گیرد که پیوند القایی بهینه شود. این توالی رویدادها، همراه با انرژی قیدی حالت پایه کورانولن و حالت گذار سطحی آن، به کمک NMR، بلورسنجی و گرماسنجی همدما، و محاسبات مستقل مربوطه تایید شد.
جی سیگلپژوهشگر دانشگاه تیانجین گفت: «ما با سیستمی فوق العاده ساده، توانایی نشان دادن همه اصول مطرح در بیوسیستم های بسیار پیچیده را داریم و می توانیم همه پارامترهای مربوطه از جمله نسبت سهم به اثر کاتالیزوری در الگوی القا و بهینه سازی پیوند ساختار گذار سطحی را دست کاری کنیم.»